题目内容
【题目】下表标出的是元素周期表前四周期的部分元素。

强调:必须用相应的化学符号回答下列问题
(1)表中用字母标出的14种元素中,化学性质最不活泼的元素是____________,属于过渡元素的是_____________(该空用字母表示)。
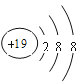
(2)G元素原子结构示意图为___________。K元素简单离子结构示意图为__________。
(3)D、G、I、L简单离子半径大小顺序是________________。(用离子符号表示)
(4)C、D、H的气态氢化物的稳定性大小顺序是_______________。(用分子式表示)
(5)表中所给元素的最高价氧化物水化物中碱性最强的是_________。(填化学式)
(6)E、F、G简单离子的氧化性大小顺序是________________。(用离子符号表示)
(7)写出元素G的氧化物与E的氢氧化物反应的离子方程式________________。
(8)I的某种氧化物和J单质的水溶液发生反应的方程式________________。
【答案】M N 
 S2->Ca2+> O2-> Al3+ H2O>NH3>H2S KOH Al3+>Mg2+>Na+ Al2O3+2OH-=2AlO2-+H2O Cl2+SO2+2H2O=H2SO4+2HCl
S2->Ca2+> O2-> Al3+ H2O>NH3>H2S KOH Al3+>Mg2+>Na+ Al2O3+2OH-=2AlO2-+H2O Cl2+SO2+2H2O=H2SO4+2HCl
【解析】
根据元素在周期表的位置可知:A是H,B是C,C是N,D是O,M 是Ne,E是Na,F是Mg,G是Al,H是P,I是S,J是Cl,K是K,L是Ca,N是Fe元素。
(1)结合元素的结构与元素在周期表的位置分析判断;
(2)G是Al元素,原子核外有3个电子层,核外电子排布为2、8、3,K是K元素,原子失去最外层电子变为K+;
(3)离子核外电子层数越多,离子半径越大;当离子核外电子层数相同时,核电荷数越大,离子半径越小;
(4)元素的非金属性越强,其相应的简单氢化物的稳定性就越强;
(5)元素的金属性越强,其相应的最高价氧化物对应的水化物的碱性就越强;
(6)元素的金属性越强,其简单离子获得电子的能力就越弱,氧化性就越弱;
(6)Al2O3是两性氧化物,能够与强酸、强碱反应;
(7)SO2具有还原性,可以与氯气在水溶液中发生氧化还原反应。
根据元素在周期表的位置可知:A是H,B是C,C是N,D是O,M 是Ne,E是Na,F是Mg,G是Al,H是P,I是S,J是Cl,K是K,L是Ca,N是Fe元素。
(1)在元素周期表中,惰性气体元素Ne原子最外层有8个电子,处于稳定状态,化学性质最不活泼,用符号M表示;Fe是过渡元素,用字母符号表示为N;
(2)G是Al元素,原子核外有3个电子层,核外电子排布为2、8、3,原子结构示意图是 ;K是K元素,核外电子排布为2、8、8、1,原子最外层只有1个电子,容易失去变成K+,具有2、8、8的电子层结构,K+简单离子结构示意图为
;K是K元素,核外电子排布为2、8、8、1,原子最外层只有1个电子,容易失去变成K+,具有2、8、8的电子层结构,K+简单离子结构示意图为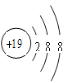 ;
;
(3) D、G、I、L简单离子分别是O2-、Al3+、S2-、Ca2+,其中O2-、Al3+具有2个电子层;S2-、Ca2+具有3个电子层,由于离子核外电子层数越多,离子半径越大;当离子核外电子层数相同时,核电荷数越大,离子半径越小,所以离子半径大小顺序为:S2->Ca2+> O2-> Al3+;
(4)元素的非金属性越强,其相应的简单氢化物的稳定性就越强。元素的非金属性O>N>S,所以简单氢化物的稳定性H2O>NH3>H2S;
(5)元素的金属性越强,其相应的最高价氧化物对应的水化物的碱性就越强。由于同一周期的元素随原子序数的增大,元素的金属性逐渐减弱;同一主族的元素,随原子序数的增大,元素的金属性逐渐增强。在上述元素中金属性最强的元素的K,所以表中所给元素的最高价氧化物水化物中碱性最强的是KOH;
(6) E、F、G分别表示Na、Mg、Al,三种元素的金属性Na>Mg>Al。元素的金属性越强,其简单离子得到电子的能力就越弱,离子的氧化性就越弱,所以三种元素的简单离子的氧化性有强到弱的顺序为Al3+>Mg2+>Na+;
(6)Al2O3是两性氧化物,能够与强酸、强碱反应。Al2O3与NaOH溶液反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O;
(7)SO2具有还原性,可以与氯气在水溶液中发生氧化还原反应,产生硫酸和盐酸,反应的化学方程式为:Cl2+SO2+2H2O=H2SO4+2HCl。

 优生乐园系列答案
优生乐园系列答案【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g) ![]() 2Z(g) ΔH< 0,一段时间后达到平衡,反应过程中测定的数据如表:下列说法正确的是( )
2Z(g) ΔH< 0,一段时间后达到平衡,反应过程中测定的数据如表:下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10-3 mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v正)
C.其他条件不变,向平衡体系中再充入0.16mol气体X,与原平衡相比,达到新平衡时,气体Y的转化率增大,X的体积分数增大,Z的体积分数减少
D.保持其他条件不变,起始时向容器中充入0.32mol气体X和0.32mol气体Y,到达平衡时,n(Z)<0.24mol
【题目】一定条件下,CO2和CO可以互相转化
(1)某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
容器 | 反应物 |
甲 | 8molCO2(g)、16molH2(g) |
乙 | wmolCO2(g)、xmolH2(g)、ymolCO(g)、zmolH2O(g) |
甲容器15min后达到平衡,此时CO2的转化率为75%,则0-15min内平均反应速率![]() (H2)=______,此条件下该反应的平衡常数K=______。欲使平衡后乙与甲中相同组分气体的体积分数相等,则w、x、y、z需满足的关系是________________,且________________(用含y的等式表示)。
(H2)=______,此条件下该反应的平衡常数K=______。欲使平衡后乙与甲中相同组分气体的体积分数相等,则w、x、y、z需满足的关系是________________,且________________(用含y的等式表示)。
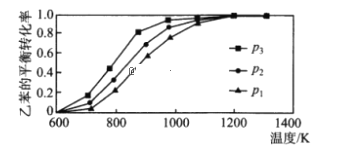
(2)研究表明,温度、压强对反应C6H5CH2CH3(g)+CO2(g) ![]() C6H5CH=CH2(g)+CO(g)+H2O(g) ΔH中乙苯的平衡转化率影响如下图所示:则ΔH ______0(填“>”“< ” 或“=”),压强p1、p2、p3从大到小的顺序是________________。
C6H5CH=CH2(g)+CO(g)+H2O(g) ΔH中乙苯的平衡转化率影响如下图所示:则ΔH ______0(填“>”“< ” 或“=”),压强p1、p2、p3从大到小的顺序是________________。
(3)CO可被NO2氧化CO+NO2 ![]() CO2+NO。当温度高于225℃时,反应速率
CO2+NO。当温度高于225℃时,反应速率![]() 正=k正·c(CO) ·c(NO2)、
正=k正·c(CO) ·c(NO2)、![]() 逆= k逆·c(CO2) ·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为______。
逆= k逆·c(CO2) ·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为______。
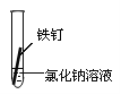
【题目】某课外小组同学对不同条件下铁钉的锈蚀进行了实验。
实验序号 | ① | ② | ③ | ④ |
实验 内容 |
|
|
|
|
一周后观察:
(1)铁钉被腐蚀程度最大的是_____________(填实验序号)。
(2)实验③中主要发生的是__________(填“化学腐蚀”或“电化学腐蚀”)。
(3)铁钉发生电化学腐蚀的负极反应式为:____________。
(4)根据上述实验,你认为铁发生电化学腐蚀的条件是________________。
(5)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上。为防护金属被腐蚀可采取的措施有_________(填序号)。
①健身器材刷油漆 ②自行车钢圈镀铬
③将钢管用导线与镁条连接 ④将钢管用导线与碳棒连接