题目内容
a g铜和足量浓硫酸完全反应,生成的二氧化硫与bg硫化氢充分反应,生成4.8g硫.下列判断一定错误的是
( )
( )
| A、a+b=6.6 | B、0.3>a/32+b/17≥0.15 | C、a=3.2,b>3.4 | D、a>3.2,b=3.4 |
分析:由Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O、SO2+2H2S=3S↓+2H2O可知,若均恰好完全反应,则Cu失去电子等于硫化氢失去电子,均等于生成4.8gS时转移电子,反应SO2+2H2S=3S↓+2H2O中可能某反应物过量,以此来解答.
| ||
解答:解:n(S)=
=0.15mol,若SO2+2H2S=3S↓+2H2O、Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O恰好反应,
由反应可知,n(SO2)=0.15mol×
=0.05mol,n(H2S)=
×0.15mol=0.1mol,n(Cu)=0.05mol,
A.若恰好反应,a+b=0.05mol×64g/mol+0.1mol×34g/mol=6.6,故A正确;
B.生成0.15molS,Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O中转移电子为0.05mol×2=0.1mol,SO2+2H2S=3S↓+2H2O中转移电子为0.05mol×(4-0)=0.2mol,
即恰好完全反应时,转移电子为
+
=0.3mol,而SO2、H2S的反应中可能某物质过量,则共转移电子数目大于0.3mol,故B错误;
C.若Cu完全反应,由电子守恒可知,0.05molCu反应,则a=0.05mol×64g/mol=3.2g,SO2+2H2S=3S↓+2H2O中硫化氢可能过量,则b>0.1mol×34g/mol=3.4g,故C正确;
D.若SO2+2H2S=3S↓+2H2O中硫化氢完全反应,b=0.1mol×34g/mol=3.4g,二氧化硫过量,则a>0.05mol×64g/mol=3.2g,故D正确;
故选B.
| 4.8g |
| 32g/mol |
| ||
由反应可知,n(SO2)=0.15mol×
| 1 |
| 3 |
| 2 |
| 3 |
A.若恰好反应,a+b=0.05mol×64g/mol+0.1mol×34g/mol=6.6,故A正确;
B.生成0.15molS,Cu+2H2SO4(浓)
| ||
即恰好完全反应时,转移电子为
| a |
| 32 |
| b |
| 17 |
C.若Cu完全反应,由电子守恒可知,0.05molCu反应,则a=0.05mol×64g/mol=3.2g,SO2+2H2S=3S↓+2H2O中硫化氢可能过量,则b>0.1mol×34g/mol=3.4g,故C正确;
D.若SO2+2H2S=3S↓+2H2O中硫化氢完全反应,b=0.1mol×34g/mol=3.4g,二氧化硫过量,则a>0.05mol×64g/mol=3.2g,故D正确;
故选B.
点评:本题考查氧化还原反应的计算,为高频考点,把握电子守恒及过量计算为解答的关键,侧重分析能力、计算能力的考查,注意电子守恒的应用,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
a g铜和足量浓硫酸完全反应,生成的二氧化硫与b g硫化氢充分反应,生成4.8g硫。下列判断一定错误的是
|
C.a =3.2,b>3.4 D.a > 3.2,b =3.4
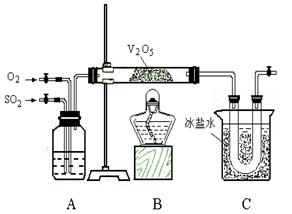
 束时得到b g 三氧化硫,该实验中二氧化硫的转化率不小于_________________;
束时得到b g 三氧化硫,该实验中二氧化硫的转化率不小于_________________; 。
。