题目内容
甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
反应II:CO2(g)+3H2(g);==CH3OH(g)+H2O(g)△H2
(1)上述反应“原子经济性”较高的是 (填“Ⅰ”或“Ⅱ”)。
(2)右表所列数据是反应I在不同温度下的化学平衡
常数(K)。由表中数据判断△H1 0(填“>”、
“=”或“<”)。
| 温度 | 25℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(3)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(1) I (2) < (3) 80% 250℃ (每空各3分)

练习册系列答案
相关题目
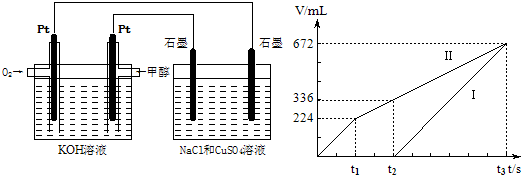
 能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
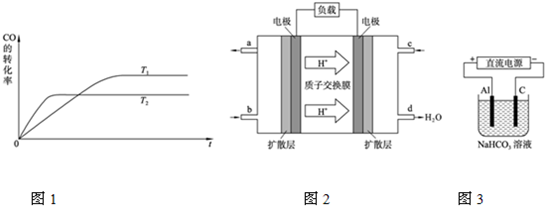
能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.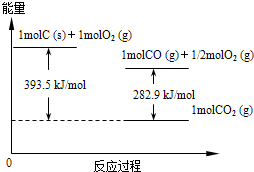 (2012?红桥区一模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(2012?红桥区一模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.