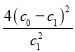题目内容
【题目】工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下(金属单质E可由滤液C制取):已知:Cu2O+2H+===Cu2++Cu+H2O。

(1)滤液A中铁元素的可能存在形式为________(填离子符号),与之相关的离子方程式为 ; 。
若滤液A中存在Fe3+,检验该离子的试剂为________(填试剂名称)。
(2)写出E和F反应生成铜的化学方程式为 。
(3)利用电解法进行粗铜精炼时,下列叙述正确的是________(填序号)。
a.若用硫酸铜溶液作电解液,![]() 向阴极移动
向阴极移动
b.粗铜接电源正极,发生还原反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.当粗铜消耗6.4 g时,转移0.2NA个电子
【答案】(1)Fe2+(或Fe2+和Fe3+) (1分)Fe2O3+6H+===2Fe3++3H2O、2Fe3++Cu===2Fe2++Cu2+
(方程式各2分)硫氰化钾(1分)
(2)2Al+3CuOAl2O3+3Cu (2分)
(3)c (1分)
【解析】
试题分析:SiO2 与盐酸不反应,Fe2O3、Al2O3、Cu2O反应,Cu2O + 2H+ = Cu + Cu2+ + H2O、Fe2O3+6H+=2 Fe3++3H2O、Al2O3+6H+=2 Al3++3H2O,而2Fe3++Cu=2Fe2++ Cu2+,可分析出滤液A中的离子一定有H+、Cu2+、Al3+,可能有Fe2+(铜较多)或Fe2+、Fe3+(铜较少)。再加入足量NaOH生成固体Cu(OH)2和铁的氢氧化物,空气中灼烧转化为F(Fe2O3 、CuO的混合物),滤液C为偏铝酸钠和NaOH的混合液,可提取金属E(为Al的单质)。
(1)可能有Fe2+(Cu2O较多)或Fe2+、Fe3+(Cu2O较少)。
(2)铝热反应2Al+3CuO= Al2O3+3Cu。
(3)电解法进行粗铜精炼时a.SO2- 4向阳极移动,错误。b.粗铜接电源正极,发生氧化反应,做阳极,错误。c.精铜作阴极,由于阳极铜和杂质金属放电,阴极只有Cu2+放电,所以电解后电解液中Cu2+浓度减小,正确。d.当粗铜消耗6.4 g时,由于阳极铜和杂质金属放电,失去电子不一定为0.2NA个,错误。