题目内容
3. 25℃时,用浓度均为0.1mol•L-1的NaOH溶液和盐酸分别滴定体积均为20mL、浓度均为0.1mol•L-1的HA溶液与BOH溶液.滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示.下列说法中正确的是( )
25℃时,用浓度均为0.1mol•L-1的NaOH溶液和盐酸分别滴定体积均为20mL、浓度均为0.1mol•L-1的HA溶液与BOH溶液.滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示.下列说法中正确的是( )| A. | HA为弱酸,BOH为强碱 | |
| B. | a点时,溶液中粒子浓度存在关系:C(B+)>c(Cl-)>c(OH-)>c(BOH ) | |
| C. | b点时两种溶液中水的电离程度相同,且V=20 | |
| D. | c、d两点溶液混合后微粒之间存在关系c (H+)═c(OH-)+c(BOH) |
分析 根据图象分析,虚线图象是HCl滴定BOH溶液,实线图象是NaOH滴定HA溶液,HA溶液与BOH溶液均为0.1mol/L,根据起始状态判断,HA溶液的pH为1,则HA完全电离,是强酸,BOH起始时溶液的pH为11,不完全电离,则BOH是弱碱,结合溶液中的守恒思想,据此判断分析.
解答 解:根据图象分析,虚线图象是HCl滴定BOH溶液,实线图象是NaOH滴定HA溶液,HA溶液与BOH溶液均为0.1mol/L,根据起始状态判断,HA溶液的pH为1,则HA完全电离,是强酸,BOH起始时溶液的pH为11,不完全电离,则BOH是弱碱,
A.HA是强酸,BOH是弱碱,故A错误;
B.a点所在曲线是0.1mol/L的HCl滴定20.00mL 0.1mol/L的BOH,根据溶液中的电荷守恒,c(H+)+c(B+)=c(OH-)+c(Cl-),溶液为碱性,大量存在BOH,溶液中c(OH-)>c(H+),则c(B+)>c(Cl-),反应产物为BCl且剩余大量的BOH,溶液中c(BOH)>c(OH-),故B错误;
C.b点时,根据图象,此时溶液pH值为6,溶液为酸性,若此时V=20,对于0.1mol/L的NaOH滴定20.00mL 0.1mol/L的HA溶液来说,此时为滴定终点,恰好生成NaA,由于HA为强酸,因为NaA不发生水解,此时应为中性,所以V=20不符合,故C错误;
D.c点对于NaOH滴定HA溶液时,溶液此时为碱性,可判断此时溶液的组分为NaOH过量和NaA,d点对于HCl滴定BOH溶液时,溶液此时为酸性,可判断溶液的组分为BCl和过量的HCl,由于c、d点时滴加NaOH或者HCl的量相同,则在c、d点时,平衡时NaOH和NaA,BCl和HCl的物料比相同,记为$\frac{c(NaOH)}{c(NaA)}$=$\frac{c(HCl)}{c(BCl)}$=x,根据反应关系和初始条件关系,可知c、d点溶液混合之后发生反应,最终溶液的组分关系为x份c(NaCl),1份c(NaA)和1份c(BCl),根据电荷守恒,c(Na+)+c(H+)+c(B+)=c(OH-)+c(A-)+c(Cl-),根据物料守恒,c(A-)=c(B+)+c(BOH),c(Na+)=c(Cl-),综合考虑,则有c (H+)═c(OH-)+c(BOH),故D正确.
故选D.
点评 本题考查滴定原理,根据图象挖掘隐含条件,得出HA是强酸,BOH是弱碱是突破口,注意滴定的终点时溶液的pH,本题难点在于没有在图象中提供数据,物料守恒建立起来不是那么容易,D项为正确答案,也是难点和易错点,需要牢牢抓住电荷守恒和物料守恒分析,本题难度较大.

| A. | 可用料酒除去食物中的腥味 | |
| B. | 葡萄糖可用于补钙药物的合成 | |
| C. | 可用乙烯作为水果的催熟剂,使水果尽快成熟 | |
| D. | 工业生产常用油脂在酸性条件下水解反应来制取肥皂 |
| A. | pH<7的溶液一定呈酸性 | |
| B. | 在纯水中加入少量硫酸,可促进水的电离 | |
| C. | 虽然固体氯化钠不能导电,但氯化钠是电解质 | |
| D. | Na2CO3溶液中,c(Na+)是c(CO32-)的两倍 |
| A. | ${\;}_{1}^{1}$H2O和${\;}_{1}^{2}$H2O | B. | 甲烷和乙烷 | ||
| C. | 石墨和C60 | D. | 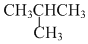 和CH3CH2CH2CH3 和CH3CH2CH2CH3 |
| A. | NaCl与浓H2SO4加热可制HCl,推测NaI与浓H2SO4加热可制HI | |
| B. | SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4 | |
| C. | FeCl3能腐蚀Cu刻制印刷电路板,是因为铁比铜金属性强 | |
| D. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 |
| A. | 淀粉和纤维素 | B. | 甲烷和乙烷 | C. | 蔗糖和麦芽糖 | D. | 12C和14C |
| A. | Z的氧化物属于碱性氧化物 | |
| B. | 原子半径:r(Y)<r(W)<r(Z) | |
| C. | W的简单气态氢化物的热稳定性比Y的强 | |
| D. | W的氧化物对应的水化物一定是强酸 |
