题目内容
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验. 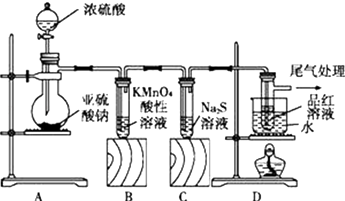
请回答下列问题:
(1)实验开始前要进行;
(2)装置A中盛放浓硫酸的仪器名称是 , 装置A中发生反应的化学方程式为
(3)实验中,装置B中发生的现象是 , 该现象说明SO2具有的性质是;
(4)装置C中无色溶液中出现黄色浑浊,说明SO2具有的性质是 .
(5)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象;
(6)尾气可采用溶液吸收,发生反应的离子方程式为 .
【答案】
(1)装置气密性检查
(2)分液漏斗;Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
(3)溶液由紫红色变为无色;还原性
(4)氧化性
(5)待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,无色溶液恢复为红色
(6)NaOH;SO2+2OH﹣=SO32﹣+H2O
【解析】解:(1.)气体发生装置和性质验证装置需要装置气密性完好,实验前需要检查装置气密性,所以答案是:装置气密性检查;
(2.)装置A中盛放浓硫酸的仪器名称是分液漏斗,利用亚硫酸钠和浓硫酸反应生成二氧化硫、硫酸钠和水,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;所以答案是:分液漏斗;Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(3.)高锰酸钾溶液为紫红色,具有氧化性,二氧化硫具有还原性,二者发生氧化还原反应,高锰酸钾溶液和二氧化硫气体发生的离子反应为:2MnO4﹣+5SO2+2H2O═2Mn2++5SO42﹣+4H+;则观察到红色逐渐变浅直至完全褪去,B中S元素的化合价升高,表现还原性,所以答案是:溶液由紫红色变为无色;还原性;
(4.)二氧化硫进入硫化钠溶液中发生的氧化还原反应为2S2﹣+SO2+2H2O=3S↓+4OH﹣ , 则观察到出现黄色浑浊,C中二氧化硫中硫元素的化合价降低,表现氧化性,所以答案是:氧化性;
(5.)因二氧化硫能使品红褪色,但加热褪色后的溶液又可恢复红色,则操作为:待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,观察到的现象为无色溶液恢复为红色,所以答案是:待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,无色溶液恢复为红色;
(6.)利用氢氧化钠溶液来吸收尾气,发生的离子反应为:SO2+2OH﹣=SO32﹣+H2O,所以答案是:NaOH;SO2+2OH﹣=SO32﹣+H2O.

【题目】用如图所示实验装置制取纯净的W气体,其中正确的一组是
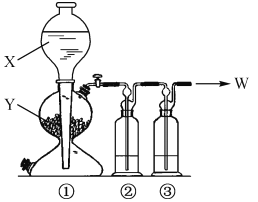
选项 | 气体W | ① | ② | ③ | |
X | Y | ||||
A | Cl2 | 浓盐酸 | MnO2 | 饱和食盐水 | 浓硫酸 |
B | SO2 | 稀硫酸 | Na2 SO3 | 饱和NaHSO3溶液 | 浓硫酸 |
C | CO2 | 稀盐酸 | 石灰石 | 饱和NaHCO3溶液 | 浓硫酸 |
D | H2S | 稀硫酸 | Na2S | NaHS溶液 | 浓硫酸 |
A. A B. B C. C D. D
