题目内容
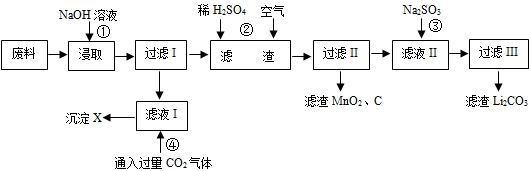
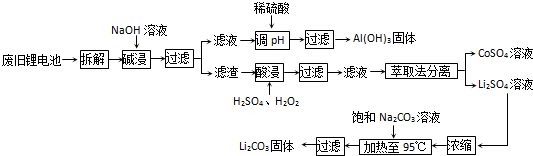
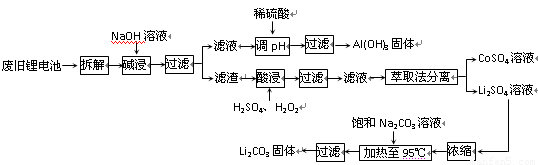
2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的.因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂.某回收工艺流程如下:
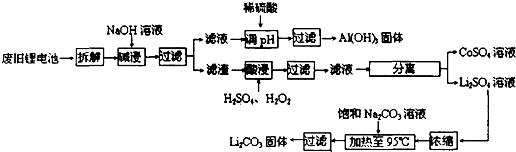
(1)上述工艺回收到的产物有
(2)Li原子的最外层电子数是
(3)碱浸时主要反应的化学方程式为
(4)最后一步过滤应趁热过滤,原因是

(1)上述工艺回收到的产物有
Al(OH)3.CoSO4.Li2CO3
Al(OH)3.CoSO4.Li2CO3
(2)Li原子的最外层电子数是
1
1
,废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是隔绝空气和水分
隔绝空气和水分
(3)碱浸时主要反应的化学方程式为
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
.(4)最后一步过滤应趁热过滤,原因是
防止析出硫酸钠晶体
防止析出硫酸钠晶体
.分析:(1)根据工艺流程的最终产物可判断回收到的产物,应为Al(OH)3、CoSO4、Li2CO3;
(2)根据Li原子的原子结构示意图;从金属锂的化学性质分析,锂为活泼金属;
(3)根据铝能和碱反应来写方程式;
(4)根据Li2CO3在水中的溶解度随着温度的升高而减小,应趁热过滤.
(2)根据Li原子的原子结构示意图;从金属锂的化学性质分析,锂为活泼金属;
(3)根据铝能和碱反应来写方程式;
(4)根据Li2CO3在水中的溶解度随着温度的升高而减小,应趁热过滤.
解答:解:(1)工艺流程的最终产物为:Al(OH)3、CoSO4、Li2CO3,故答案为:Al(OH)3.CoSO4.Li2CO3;
(2)Li原子的原子结构示意图 ,金属锂性质活泼,易与氧气、水发生反应,应隔绝空气和水分,故答案为:1;隔绝空气和水分;
,金属锂性质活泼,易与氧气、水发生反应,应隔绝空气和水分,故答案为:1;隔绝空气和水分;
(3)铝能与碱反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
(4)Li2CO3在水中的溶解度随着温度的升高而减小,应趁热过滤,防止析出硫酸钠晶体,故答案为:防止析出硫酸钠晶体.
(2)Li原子的原子结构示意图
 ,金属锂性质活泼,易与氧气、水发生反应,应隔绝空气和水分,故答案为:1;隔绝空气和水分;
,金属锂性质活泼,易与氧气、水发生反应,应隔绝空气和水分,故答案为:1;隔绝空气和水分;(3)铝能与碱反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
(4)Li2CO3在水中的溶解度随着温度的升高而减小,应趁热过滤,防止析出硫酸钠晶体,故答案为:防止析出硫酸钠晶体.
点评:本题为生产流程题,涉及金属的回收、氧化还原反应、物质的分离提纯和除杂等问题,题目较为综合,难度中等.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案
相关题目