题目内容
(10分)将镁条在空气中燃烧的全部产物(氧化镁和氮化镁)溶解在50mL 1.8mol·L-1的盐酸中,再以20mL 0.9mol·L-1的NaOH中和多余的酸。然后再向溶液中加入过量的NaOH溶液将氨全部蒸发出来,用足量的盐酸吸收,经测定氨的质量为0.102g,求镁条的质量。(提示:N2+3Mg Mg3N2,Mg3N2+8HCl3MgCl2+2NH4Cl)
Mg3N2,Mg3N2+8HCl3MgCl2+2NH4Cl)
 Mg3N2,Mg3N2+8HCl3MgCl2+2NH4Cl)
Mg3N2,Mg3N2+8HCl3MgCl2+2NH4Cl)0.792g?
根据题意示意如下:
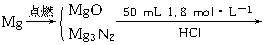

根据Mg→MgCl2,要求n(Mg)必先求n(Cl-),反应过程中Cl-守恒,可依此建立等量关系。?
设镁的物质的量为x,
n(NH4Cl)=n(NH3)=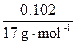 ="0.006" mol?
="0.006" mol?
n(NaCl)="0.9" mol·L-1×20×10-3L="0.018" mol?
根据Cl-守恒有:?
1.8 mol·L-1×50×10-3L=2x+0.006 mol+0.018 mol?
x="0.033" mol。?
镁条的质量为:0.033 mol×24 g·mol-1="0.792" g。?
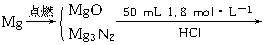

根据Mg→MgCl2,要求n(Mg)必先求n(Cl-),反应过程中Cl-守恒,可依此建立等量关系。?
设镁的物质的量为x,
n(NH4Cl)=n(NH3)=
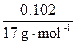 ="0.006" mol?
="0.006" mol?n(NaCl)="0.9" mol·L-1×20×10-3L="0.018" mol?
根据Cl-守恒有:?
1.8 mol·L-1×50×10-3L=2x+0.006 mol+0.018 mol?
x="0.033" mol。?
镁条的质量为:0.033 mol×24 g·mol-1="0.792" g。?

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目