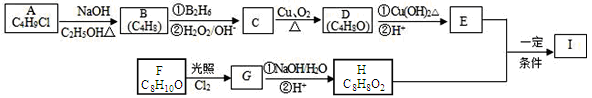
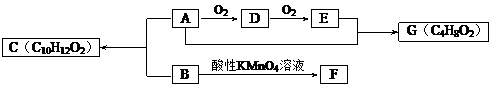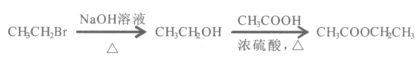题目内容
【题目】某溶液由K+、Cu2+、Ca2+、Al3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:
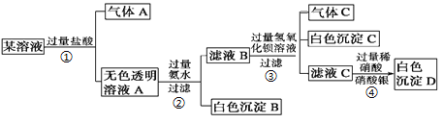
根据上述实验回答下列问题:
(1)写出气体A的电子式 ,气体C的结构式 。
(2)写出过程①中的离子方程式 、 。
(3)根据上述实验 (填“能”或“不能”)确定原溶液中存在K+,说明理由 ;过程④中的现象 (填“能”或“不能”)证明原溶液中存在Cl-,说明理由 。
【答案】
(1) ![]() ;
;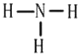
(2)CO32-+ 2H+= CO2↑+ H2O、AlO2-+ 4H+ =Al3+ + 2H2O;
(3)能;由过程①可知原溶液中一定存在CO32-,根据离子共存原则,原溶液中一定不存在Cu2+、Ca2+、Al3+,又知溶液呈电中性,则一定含K+;不能;由于过程①向原溶液中引入Cl-,所以过程④中的现象不能证明原溶液中含Cl-。
【解析】
试题分析:向其中加入过量盐酸,有气体A生成,并得到无色透明溶液,则溶液中含有CO32-离子,则不存在Cu2+、Ca2+、Al3+离子,根据溶液呈电中性,一定含有K+离子;向溶液A中加入过量氨水,产生白色沉淀,该沉淀为Al(OH)3,则原溶液中含有AlO2-离子;滤液B中加入过量氢氧化钡溶液,产生白色沉淀,该沉淀为BaSO4,说明原溶液中含有SO42-离子;向滤液C中加入过量稀硝酸,再加入硝酸银溶液,产生白色沉淀,该沉淀是AgCl,但不能证明原溶液中是否含有Cl-离子,。
(1)气体A为二氧化碳,电子式为![]() ,气体C为氨气,结构式为
,气体C为氨气,结构式为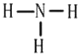 ,故答案为:
,故答案为:![]() ;
;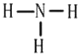 ;
;
(2)过程①中的离子方程式有CO32-+ 2H+= CO2↑+ H2O、AlO2-+ 4H+ =Al3+ + 2H2O,故答案为:CO32-+ 2H+= CO2↑+ H2O、AlO2-+ 4H+ =Al3+ + 2H2O;
(3)根据上述实验能确定原溶液中存在K+,因为过程①可知原溶液中一定存在CO32-,根据离子共存原则,原溶液中一定不存在Cu2+、Ca2+、Al3+,又知溶液呈电中性,则一定含K+;过程④中的现象不能证明原溶液中存在Cl-,因为在第一步中加入盐酸,故答案为:能;由过程①可知原溶液中一定存在CO32-,根据离子共存原则,原溶液中一定不存在Cu2+、Ca2+、Al3+,又知溶液呈电中性,则一定含K+;不能;由于过程①向原溶液中引入Cl-,所以过程④中的现象不能证明原溶液中含Cl-。