题目内容
已知:298K时,N2(g)+3H2(g) 2NH3(g)△H=-92.2kJ?mol-1.
2NH3(g)△H=-92.2kJ?mol-1.
(1)若N≡N的键能为941.3kJ?mol-1,H-H的键能为436.4kJ?mol-1,则N-H的键能为
(2)实验室将1.1mol N2、3mol H2充入2L容器,一定条件下反应.
①若2min末测得H2的物质的量为1.8mol,则该时间段内氨气的平均反应速率为
②下列措施可加快该反应速率的是
A.充入He气 B.使用恰当的催化剂
C.升高反应体系的温度 D.再充入N2
③当下列物理量保持不变时,表明该反应一定处于化学平衡状态的是
A.容器内N2与H2的浓度比 B.容器内气体密度
C.恒温下气体的压强 D.H2的物质的量
④充分反应后恢复到298K,反应过程中放出的热量
(1)若N≡N的键能为941.3kJ?mol-1,H-H的键能为436.4kJ?mol-1,则N-H的键能为
390.5kJ?mol-1
390.5kJ?mol-1
.(2)实验室将1.1mol N2、3mol H2充入2L容器,一定条件下反应.
①若2min末测得H2的物质的量为1.8mol,则该时间段内氨气的平均反应速率为
0.2mol/(L?min)
0.2mol/(L?min)
.②下列措施可加快该反应速率的是
B、C、D
B、C、D
.A.充入He气 B.使用恰当的催化剂
C.升高反应体系的温度 D.再充入N2
③当下列物理量保持不变时,表明该反应一定处于化学平衡状态的是
A、C、D
A、C、D
.A.容器内N2与H2的浓度比 B.容器内气体密度
C.恒温下气体的压强 D.H2的物质的量
④充分反应后恢复到298K,反应过程中放出的热量
<
<
92.2kJ(填“>”、“=”、“<”),理由可逆反应不可能进行到底,生成NH3的物质的量小于2mol
可逆反应不可能进行到底,生成NH3的物质的量小于2mol
.分析:(1)根据断键吸收的能量、成键放出的能量与反应热的关系来计算;
(2)①先计算氢气的反应速率,再利用速率之比等于化学计量数之比来计算氨气的平均反应速率;
②根据温度、浓度、催化剂对化学反应速率的影响来分析;
③根据化学平衡的特征“等”、“定”来分析;
④化学平衡的不完全转化性及热化学反应方程式中反应热的意义来分析.
(2)①先计算氢气的反应速率,再利用速率之比等于化学计量数之比来计算氨气的平均反应速率;
②根据温度、浓度、催化剂对化学反应速率的影响来分析;
③根据化学平衡的特征“等”、“定”来分析;
④化学平衡的不完全转化性及热化学反应方程式中反应热的意义来分析.
解答:解:(1)由N2(g)+3H2(g) 2NH3(g)△H=-92.2kJ?mol-1,
2NH3(g)△H=-92.2kJ?mol-1,
设N-H的键能为为x,则
941.3kJ?mol-1+3×436.4kJ?mol-1-x×6=-92.2kJ?mol-1,
解得x=390.5 kJ?mol-1,故答案为:390.5kJ?mol-1;
(2)①2min内参加反应H2的物质的量为3mol-1.8mol=1.2mol,则氢气的反应速率为
=0.3mol/(L?min),
由反应速率之比等于化学计量数之比,则氨气的平均反应速率为0.3mol/(L?min)×
=0.2mol/(L?min),
故答案为:0.2mol/(L?min);
②A.充入He气,因体积不变,则反应中各物质的浓度不变,反应速率不变,故A不选;
B.使用恰当的催化剂,降低了反应所需的活化能,反应速率加快,故B选;
C.升高反应体系的温度,活化分子的百分数增大,反应速率加快,故C选;
D.再充入N2,反应物的浓度变大,反应速率加快,故D选;
故答案为:B、C、D;
③A.容器内N2与H2的浓度比不变时,正逆反应速率相等,化学反应达到平衡,故A选;
B.容器内气体密度始终不变,则不能判断化学反应达到平衡,故B不选;
C.恒温下气体的压强不变时,正逆反应速率相等,化学反应达到平衡,故C选;
D.H2的物质的量不变,则浓度不变,正逆反应速率相等,化学反应达到平衡,故D选;
故答案为:A、C、D;
④因该反应为可逆反应,不能完全转化,而热化学反应中的反应热为物质完全转化时的能量变化,故答案为:<;可逆反应不可能进行到底,生成NH3的物质的量小于2mol.
设N-H的键能为为x,则
941.3kJ?mol-1+3×436.4kJ?mol-1-x×6=-92.2kJ?mol-1,
解得x=390.5 kJ?mol-1,故答案为:390.5kJ?mol-1;
(2)①2min内参加反应H2的物质的量为3mol-1.8mol=1.2mol,则氢气的反应速率为
| ||
| 2min |
由反应速率之比等于化学计量数之比,则氨气的平均反应速率为0.3mol/(L?min)×
| 2 |
| 3 |
故答案为:0.2mol/(L?min);
②A.充入He气,因体积不变,则反应中各物质的浓度不变,反应速率不变,故A不选;
B.使用恰当的催化剂,降低了反应所需的活化能,反应速率加快,故B选;
C.升高反应体系的温度,活化分子的百分数增大,反应速率加快,故C选;
D.再充入N2,反应物的浓度变大,反应速率加快,故D选;
故答案为:B、C、D;
③A.容器内N2与H2的浓度比不变时,正逆反应速率相等,化学反应达到平衡,故A选;
B.容器内气体密度始终不变,则不能判断化学反应达到平衡,故B不选;
C.恒温下气体的压强不变时,正逆反应速率相等,化学反应达到平衡,故C选;
D.H2的物质的量不变,则浓度不变,正逆反应速率相等,化学反应达到平衡,故D选;
故答案为:A、C、D;
④因该反应为可逆反应,不能完全转化,而热化学反应中的反应热为物质完全转化时的能量变化,故答案为:<;可逆反应不可能进行到底,生成NH3的物质的量小于2mol.
点评:本题考查影响化学反应速率及化学平衡的因素,难度不大,注意利用浓度分析反应速率及化学平衡时解答本题的关键.

练习册系列答案
相关题目
 (1)下图是太阳能电池板经太阳光照射前后内部电子的变化情况,图乙中灯泡变亮,其中____(填写“N”或“P”)是正极。
(1)下图是太阳能电池板经太阳光照射前后内部电子的变化情况,图乙中灯泡变亮,其中____(填写“N”或“P”)是正极。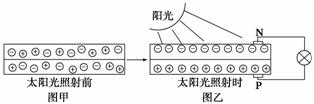
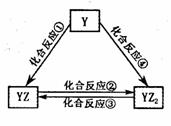 II.X、Y、Z、Q、R5种短周期元素原子序数依次增大。化合物甲由X、Z、Q3种元素组成,常温下,0.1mol·L-l甲溶液的pH =13。工业上常用电解QR饱和溶液生产甲
II.X、Y、Z、Q、R5种短周期元素原子序数依次增大。化合物甲由X、Z、Q3种元素组成,常温下,0.1mol·L-l甲溶液的pH =13。工业上常用电解QR饱和溶液生产甲