��Ŀ����
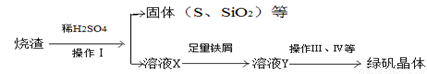
���᳧�����ջ�����(FeS2)��ȡ���ᣬʵ�����������᳧����(��Ҫ�ɷ���Fe2O3������FeS��SiO2�Ʊ��̷���
��һ��SO2��O2��Ӧ��ȡ�ķ�Ӧԭ��Ϊ��2SO2��O2 2SO3����һ�ܱ�������һ��ʱ���ڴﵽƽ�⡣
2SO3����һ�ܱ�������һ��ʱ���ڴﵽƽ�⡣
��1���÷�Ӧ��ƽ�ⳣ������ʽΪ______��
��2���÷�Ӧ�ﵽƽ��״̬�ı�־��______��
A��v(SO2)=v(SO3) B��������ƽ����Է�����������
C����������������� D������ֵ������������
������ij���е�λ����ԭ���ԭ������SO2��O2�Ʊ����ᣬװ����ͼ���缫Ϊ��IJ��ϣ����������壬ͬʱҲ��ʹ������������Һ��ֽӴ���

��3��B�缫�ĵ缫��ӦʽΪ______����Һ��H�����ƶ�������______����______��������ܷ�ӦʽΪ______��
�����������������̷��Ĺ�������
�ⶨ�̷���Ʒ�к�����ʵ�鲽�裺
a����ȡ5.7 g��Ʒ���ܽ⣬���250 mL����Һ��
b����ȡ25 ml������Һ����ƿ�С�
c���������ữ��0. 01 mol/LKMnO4 ��Һ�ζ����յ㣬����KMnO4��Һ���40 mL��������������ͬ���������⡣
��4���ζ�ʱ������Ӧ�����ӷ���ʽΪ����ɲ���ƽ���ӷ�Ӧ����ʽ����

��5���������ữ��KMnO4�ζ��յ�ı�־��
��6������������Ʒ�е�FeSO4.7H2O��������Ϊ______��
��1�� ��2�� B D ��3��SO2+2H2O-2e-=SO42-+4H+
B A
��2�� B D ��3��SO2+2H2O-2e-=SO42-+4H+
B A
2SO2+O2+2H2O=2H2SO4(��2SO2+O2+2H2O=4H++2SO42-)��4��5 Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
��5���ζ����һ������KMnO4ʱ��Һ�ʵ���ɫ��������ڲ���ɫ����6��0.975��97.5%
��������
�����������1����Ӧ2SO2��O2 2SO3��ƽ�ⳣ������ʽΪ
2SO3��ƽ�ⳣ������ʽΪ ��2��Aû��ָ��������Ӧ���ʻ����淴Ӧ���ʣ�û�����塣����B.���ڸ÷�Ӧ�Ƿ�Ӧǰ������������ȵķ�Ӧ�����Ե���Ӧ�ﵽƽ��ʱ������������ʵ������䣬�������ƽ����Է����������䡣��ȷ��C���κη�Ӧ���۽��е�ʲô�̶ȣ���������������Dz��䣬=����˲�����Ϊ��Ӧ�ﵽƽ��״̬�ı�־������D�����ڸ÷�Ӧ�Ƿ�Ӧǰ������������ȵķ�Ӧ�����Ե���Ӧ�ﵽƽ��ʱ������������ʵ������䣬������������Ҳ���䣬��������䣬���Ը���ֵ�����������䡣��ȷ�����Ը÷�Ӧ�ﵽƽ��״̬�ı�־��B D����3����Ϊ��B�缫������H2SO4��˵��SO2��B�缫��ʧȥ���ӣ����B�缫Ϊ�������缫��ӦʽΪSO2+2H2O-2e-=SO42-+4H+����ͬ�ֵ����ų⣬���ֵ���������ԭ����Һ��H�����ƶ�������B�缫��A�缫������ܷ�ӦʽΪ2SO2+O2+2H2O=2H2SO4����4���ζ�ʱ������Ӧ�����ӷ���ʽΪ5 Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O����5������KMnO4Ϊ��ɫ�����Բ������ָʾ���������䱾������ɫ�仯���жϷ�Ӧ�յ㡣����������ữ��KMnO4�ζ��յ�ı�־�ǵζ����һ������KMnO4ʱ��Һ�ʵ���ɫ��������ڲ���ɫ��n(KMnO4)= 0. 01 mol/L��0.04L��(250��25)=4��10-3mol.��n(Fe2+)=5 n(KMnO4)= 5��4��10-3mol=0.02mol.����������Ʒ�е�FeSO4.7H2O��������Ϊ(0.02mol��278g/mol) ��5.7 g��100%=97.5%.
��2��Aû��ָ��������Ӧ���ʻ����淴Ӧ���ʣ�û�����塣����B.���ڸ÷�Ӧ�Ƿ�Ӧǰ������������ȵķ�Ӧ�����Ե���Ӧ�ﵽƽ��ʱ������������ʵ������䣬�������ƽ����Է����������䡣��ȷ��C���κη�Ӧ���۽��е�ʲô�̶ȣ���������������Dz��䣬=����˲�����Ϊ��Ӧ�ﵽƽ��״̬�ı�־������D�����ڸ÷�Ӧ�Ƿ�Ӧǰ������������ȵķ�Ӧ�����Ե���Ӧ�ﵽƽ��ʱ������������ʵ������䣬������������Ҳ���䣬��������䣬���Ը���ֵ�����������䡣��ȷ�����Ը÷�Ӧ�ﵽƽ��״̬�ı�־��B D����3����Ϊ��B�缫������H2SO4��˵��SO2��B�缫��ʧȥ���ӣ����B�缫Ϊ�������缫��ӦʽΪSO2+2H2O-2e-=SO42-+4H+����ͬ�ֵ����ų⣬���ֵ���������ԭ����Һ��H�����ƶ�������B�缫��A�缫������ܷ�ӦʽΪ2SO2+O2+2H2O=2H2SO4����4���ζ�ʱ������Ӧ�����ӷ���ʽΪ5 Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O����5������KMnO4Ϊ��ɫ�����Բ������ָʾ���������䱾������ɫ�仯���жϷ�Ӧ�յ㡣����������ữ��KMnO4�ζ��յ�ı�־�ǵζ����һ������KMnO4ʱ��Һ�ʵ���ɫ��������ڲ���ɫ��n(KMnO4)= 0. 01 mol/L��0.04L��(250��25)=4��10-3mol.��n(Fe2+)=5 n(KMnO4)= 5��4��10-3mol=0.02mol.����������Ʒ�е�FeSO4.7H2O��������Ϊ(0.02mol��278g/mol) ��5.7 g��100%=97.5%.
���㣺�������ջ�������ȡ���ᡢ�����᳧�����Ʊ��̷��ķ�Ӧԭ������Ӧ�Ļ�ѧ�����֪ʶ��

 ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д� ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д� ����ϰ�⽭��ϵ�д�
����ϰ�⽭��ϵ�д�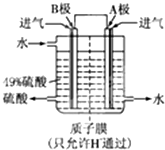
 2SO3����һ�ܱ�������һ��ʱ���ڴﵽƽ�⣮
2SO3����һ�ܱ�������һ��ʱ���ڴﵽƽ�⣮
 + ���� Fe3++ Mn2++
+ ���� Fe3++ Mn2++  2SO3����һ�ܱ�������һ��ʱ���ڴﵽƽ�⣮
2SO3����һ�ܱ�������һ��ʱ���ڴﵽƽ�⣮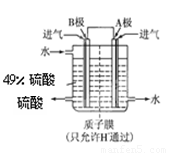
 +
����
Fe3++ Mn2++
+
����
Fe3++ Mn2++ 