题目内容
9.碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.已知Ksp(AgCl)=1.77×10-10,Ksp(AgI)=8.5×10-17.回答下列问题:(1)大量的碘富集在海藻中,用水浸取后浓缩,浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$为:4.8×10-7.
(2)将足量的氯化银分别放入:
①100mL的水中 ②100mL 0.1mol/L盐酸中
③100mL 0.1mol/L氯化铝溶液中 ④100mL 0.1mol/L氯化镁溶液中
⑤100mL 0.1mol/L硝酸银溶液中
搅拌后,相同温度下,银离子浓度最大的是⑤(填序号).在100mL 0.1mol/L氯化镁溶液中,银离子的浓度最大可达到8.85×10-10mol/L.
(3)已知反应2HI(g)═H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为299kJ.
分析 (1)AgCl开始沉淀时,说明溶液中的c(I-)和c(Cl-)均已达到饱和状态,所以溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$=$\frac{\frac{Ksp(AgI)}{c(A{g}^{+})}}{\frac{Ksp(AgCl)}{c(A{g}^{+})}}$=$\frac{Ksp(AgI)}{Ksp(AgCl)}$;
(2)AgCl是水溶液中存在溶解平衡,AgCl电离银离子和氯离子,银离子或氯离子都抑制AgCl溶解,但硝酸银溶液中银离子浓度最大;在100mL 0.1mol/L氯化镁溶液中,c(Ag+)=$\frac{Ksp}{c(C{l}^{-})}$;
(3)正反应为吸热反应,化学键断裂时需吸收的能量-化学键生成时需放出的能量=反应吸收的热量.
解答 解:(1)AgCl开始沉淀时,说明溶液中的c(I-)和c(Cl-)均已达到饱和状态,所以溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$=$\frac{\frac{Ksp(AgI)}{c(A{g}^{+})}}{\frac{Ksp(AgCl)}{c(A{g}^{+})}}$=$\frac{Ksp(AgI)}{Ksp(AgCl)}$=$\frac{8.5×1{0}^{-17}}{1.77×1{0}^{-10}}$=4.8×10-7,
故答案为:4.8×10-7;
(2)AgCl是水溶液中存在溶解平衡,AgCl电离银离子和氯离子,银离子或氯离子都抑制AgCl溶解,硝酸银是可溶性强电解质,虽然抑制氯化银溶解,但硝酸银在水溶液中的溶解度大,所以硝酸银溶液中银离子浓度最大;在100mL 0.1mol/L氯化镁溶液中,c(Ag+)=$\frac{Ksp}{c(C{l}^{-})}$=$\frac{1.77×1{0}^{-10}}{0.2}$mol/L=8.85×10-10mol/L;
故答案为:⑤;8.85×10-10mol/L;
(3)设1molHI(g)分子中化学键断裂时需吸收的能量为x kJ,则:2x kJ-436kJ-151kJ=11kJ,解得x=299,
故答案为:299.
点评 本题考查以离子浓度大小比较为载体考查难溶物的溶解平衡,侧重考查学生分析计算能力,注意溶度积常数的灵活运用,易错点是(2)中银离子浓度最大溶液判断,很多同学往往因为硝酸银溶液抑制氯化银溶解而认为硝酸银溶液中离子浓度很小而导致错误,题目难度不大.

 天天练口算系列答案
天天练口算系列答案| A. | 丙烷分子中三个碳原子在一条直线上 | |
| B. | 符合通式CnH2n+2的均属于烷烃 | |
| C. | 丙烷的二氯代物有5种 | |
| D. | 丁烷能与氯气在光照时发生加成反应 |
①锂单质跟钠单质的保存方法一样,均可保存在煤油中
②金属锂在空气中燃烧时,生成Li2O
③氢氧化锂的碱性比氢氧化铷弱.
| A. | ①② | B. | ①③ | C. | ①②③ | D. | ②③ |
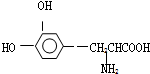 这种药物的研制是基于获得2000年诺贝尔生理学或医学奖和获得2001年诺贝尔化学奖的研究成果.下列关于L-多巴的叙述不正确的是( )
这种药物的研制是基于获得2000年诺贝尔生理学或医学奖和获得2001年诺贝尔化学奖的研究成果.下列关于L-多巴的叙述不正确的是( )| A. | 该有机物可看作氨基酸,也可看作是酚类物质 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 分子中至少有7个碳原子在同一平面内 | |
| D. | 既能与溴水发生取代反应,又能与溴水发生加成反应 |
 ,其单体不可能具有的化学性质是( )
,其单体不可能具有的化学性质是( )| A. | 能使酸性KMnO4溶液褪色 | B. | 与NaOH溶液共热可生成一种钠盐 | ||
| C. | 能催化加氢生成2甲基丙酸甲酯 | D. | 能发生缩聚反应 |
| A. | SiO2、NaCl、CO2 | B. | HF、HCl、HBr | C. | NaCl、KCl、RbCl | D. | Na、Mg、Al |
