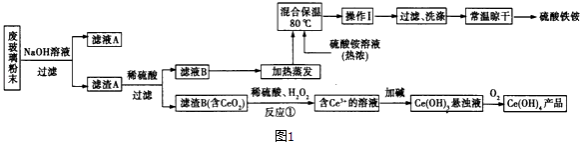
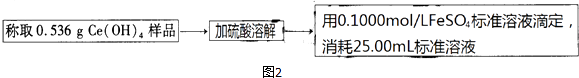
题目内容
【题目】资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
(1)有科学家提出可利用FeO吸收和利用CO2 , 相关热化学方程式如下:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s)△H=﹣76.0kJmol﹣1
①上述反应中每生成1mol Fe3O4 , 转移电子的物质的量为mol.
②已知:C(s)+2H2O(g)=CO2 (g)+2H2(g)△H=+113.4kJmol﹣1 , 则反应:
3FeO(s)+H2O (g)=Fe3O4 (s)+H2 (g)的△H= .
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2 (g)CH4 (g)+2H2O(g)△H=QkJmol﹣1 , 向一容积为 2L的恒容密闭容器中充人2molCO2和8mol H2 , 在 300℃时发生上述反应,达到平衡时,测得CH4的浓度为0.8molL﹣1 , 则300℃时上述反应的平衡常数K= . 200℃时该反应的平衡常数K=64.8,则该反应的Q(填“>”或“<”)0.
【答案】
(1)2;+18.7kJ?mol﹣1
(2)25;<
【解析】解:(1)①由方程式可知,每生成1mol Fe3O4时生成0.5molC,C元素化合价由+4价降低为0价,故转移电子为0.5mol×4=2mol,故答案为:2;②已知:Ⅰ.6FeO(s)+CO2(g)=2Fe3O4(s)+C(s)△H=﹣76.0kJmol﹣1
Ⅱ.C(s)+2H2O(g)=CO2 (g)+2H2(g)△H=+113.4kJmol﹣1 , 根据盖斯定律,(Ⅰ+Ⅱ)× ![]() 可得:3FeO(s)+H2O (g)=Fe3O4 (s)+H2 (g),则△H=
可得:3FeO(s)+H2O (g)=Fe3O4 (s)+H2 (g),则△H= ![]() ×(﹣76.0kJmol﹣1+113.4kJmol﹣1)=+18.7kJmol﹣1 , 故答案为:+18.7kJmol﹣1;(2)向一容积为 2L的恒容密闭容器中充人2molCO2和8mol H2 , 在 300℃时发生上述反应,达到平衡时,测得CH4的浓度为0.8molL﹣1 , 则:
×(﹣76.0kJmol﹣1+113.4kJmol﹣1)=+18.7kJmol﹣1 , 故答案为:+18.7kJmol﹣1;(2)向一容积为 2L的恒容密闭容器中充人2molCO2和8mol H2 , 在 300℃时发生上述反应,达到平衡时,测得CH4的浓度为0.8molL﹣1 , 则:
CO2(g)+4H2 (g)CH4 (g)+2H2O(g)
起始量(mol/L):1 4 0 0
变化量(mol/L):0.8 3.2 0.8 1.6
平衡量(mol/L):0.2 0.8 0.8 1.6
平衡常数K= ![]() =
= ![]() =25,200℃时该反应的平衡常数K=64.8,大于300℃时该反应的平衡常数25,说明降低温度平衡向正反应方向移动,故正反应为放热反应,即Q<0,故答案为:25;<.
=25,200℃时该反应的平衡常数K=64.8,大于300℃时该反应的平衡常数25,说明降低温度平衡向正反应方向移动,故正反应为放热反应,即Q<0,故答案为:25;<.
(1)①反应中Fe元素化合价升高,C元素化合价降低,计算生成C的物质的量,结合C元素化合价变价计算转移电子物质的量;②已知:Ⅰ.6FeO(s)+CO2(g)=2Fe3O4(s)+C(s)△H=﹣76.0kJmol﹣1Ⅱ.C(s)+2H2O(g)=CO2 (g)+2H2(g)△H=+113.4kJmol﹣1 ,
根据盖斯定律,(Ⅰ+Ⅱ)× ![]() 可得:3FeO(s)+H2O (g)=Fe3O4 (s)+H2 (g),焓变也进行需要计算;(2)向一容积为 2L的恒容密闭容器中充人2molCO2和8mol H2 , 在 300℃时发生上述反应,达到平衡时,测得CH4的浓度为0.8molL﹣1 , 则:
可得:3FeO(s)+H2O (g)=Fe3O4 (s)+H2 (g),焓变也进行需要计算;(2)向一容积为 2L的恒容密闭容器中充人2molCO2和8mol H2 , 在 300℃时发生上述反应,达到平衡时,测得CH4的浓度为0.8molL﹣1 , 则:
CO2(g)+4H2 (g)CH4 (g)+2H2O(g)
起始量(mol/L):1 4 0 0
变化量(mol/L):0.8 3.2 0.8 1.6
平衡量(mol/L):0.2 0.8 0.8 1.6
代入K= ![]() 计算平衡常数,再根据平衡常数相对大小判断温度对平衡移动的影响.
计算平衡常数,再根据平衡常数相对大小判断温度对平衡移动的影响.

 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】下表是元素周期表的一部分,请回答有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为______.
(2)表中能形成两性氢氧化物的元素是______ (用元素符号表示),写出该元素的单质与⑨最高价氧化物对应水化物反应的化学方程式______.
(3)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入如表___.
实验现象与结论 | |
【题目】雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一.消除氮氧化物和硫氧化物有多种方法.可用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)═N2(g)+CO2(g)△H=QkJmol﹣1 . 在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
0~10min内,CO2的平均反应速率v(CO2)= , 反应进行到30min时,NO 的转化率= .