��Ŀ����
����Ŀ��ij�о���ѧϰС�������һ��ʵ�飬��֤Ԫ�������ɣ�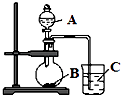
��1����ͬѧ��a��b��c��d��ֻ�ձ���ֱ����50mL��ˮ���ٷֱ�μӼ��η�̪��Һ�����μ����С������ƣ�Na����þ��Mg��������Al�����أ�K�������飬�۲����ټ�ͬѧ���ʵ���Ŀ������֤��ͬһ���壬���ϵ���Ԫ�ص�Ԫ�ؽ���������ǿ��ͬһ���ڣ������ң�Ԫ�ؽ�������
�ڷ�Ӧ����ҵ��ձ��������������ĸ��
A���� B��þ C���� D���أ�
��д��a�ձ������Ӧ�����ӷ���ʽ ��
��ʵ���з���b��c��ֻ�ձ��м���û��ʲô����Ҫ��ﵽʵ���Ŀ�ģ��������ѡ�����к��ʵķ��� ��
A����þ�����Ľ����黻�ɽ�����ĩ
B�����ձ��е���ˮ������ˮ
C�����ձ��е���ˮ��������
D�����ձ��е���ˮ��������������Һ
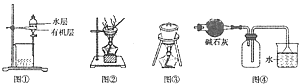
��2����ͬѧ���ʵ����֤���ǽ���Ԫ�صķǽ�����Խǿ������ۺ���������Ծ�Խǿ�����������ͼװ������֤̼��������Ԫ�صķǽ�����ǿ������ͬѧ��Ƶ�ʵ���ֱ��֤�������������ǿ������֪A��ǿ�ᣬ��Ũ��Һ�ڳ����¿���ͭ��Ӧ��B�ǿ�״���壻�ձ���ʢ��C��ˮ��Һ����Һ©���Ļ�����C�пɹ۲쵽��ɫ��״�������ɣ���д����ѡ�����ʵĻ�ѧʽ��A���� C�� ��
��д����ƿ�з�����Ӧ�Ļ�ѧ����ʽ�� ��
��̼������������Ԫ�صķǽ�������ǿ����˳��Ϊ ��
���𰸡�
��1��������D��2Na+2H2O=2Na++2OH��+H2����BC
��2��HNO3��Na2SiO3����K2SiO3����2HNO3+CaCO3=Ca��NO3��2+H2O+CO2��������̼����
���������⣺��1���ٸ���Ԫ�������ɿ�֪��ͬѧ���ʵ���Ŀ������֤��ͬһ���壬���ϵ���Ԫ�ص�Ԫ�ؽ���������ǿ��ͬһ���ڣ������ң�Ԫ�ؽ��������������Դ��ǣ��������ڽ����ԣ�K��Na��Mg��Al��������Խǿ��������ˮ��ӦԽ���ң��ʷ�Ӧ����ҵ��ձ���D�����Դ��ǣ�D��������ˮ��Ӧ�����������ƺ���������Ӧ�����ӷ���ʽ��2Na+2H2O=2Na++2OH��+H2�������Դ��ǣ�2Na+2H2O=2Na++2OH��+H2�����ܷ�Ӧ�������ԣ�˵����Ӧ����С�������¶ȿ��Լӿ����ʣ�������ˮ��Ϊ��ˮ����ˮ��Ϊ������������Һ�������ӵ�Ũ�ȣ����Լӿ����ʣ����Դ��ǣ�BC����2��������ǿ���Ʊ�������У�A��ǿ�ᣬ�����¿���ͭ��Ӧ�����B�ǿ�״���壬��Һ©���Ļ�����C�пɹ۲쵽��ɫ�������ɣ���BΪ̼��ơ�CΪ�����ƻ����أ����Դ��ǣ�HNO3��Na2SiO3����K2SiO3��������ƿ�з���������̼��Ƶķ�Ӧ������ʽΪ2HNO3+CaCO3=Ca��NO3��2+H2O+CO2�������Դ��ǣ�2HNO3+CaCO3=Ca��NO3��2+H2O+CO2������Ԫ�صķǽ�����Խǿ����Ӧ������������ˮ���������Խǿ���Լ���ǿ���Ʊ�������ԭ������ʵ���֪���ԣ��������̼�ᣬ̼����ڹ��ᣬ��ǽ����Ե���̼���裬���Դ��ǣ�����̼���裮

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�