题目内容
(12分)化学反应速率与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 50 | 120 | 232 | 288 | 310 |
① 哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最小 ,
原因是 。
② 哪一时间段的反应速率最大 ,原因是 。
③ 求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率 。
(设溶液体积不变)
④ 如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他可采取的措施是 :
A.加蒸馏水 B.加Na2CO3溶液 C.加NaCl溶液 D.加NaNO3溶液
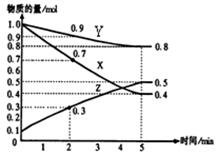
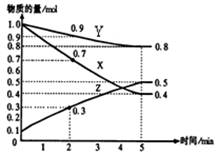
(2)已知某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。该反应的化学方程式为: 。
(1)① 4~5 min(1分),因为4~5 min时H+ 浓度小。
② 2~3 min(1分),该反应是放热反应,2~3 min时温度高。
③ 0.025mol/(L•min) ④ AC (2)3X+Y 2Z
解析:相等的时间段放出的氢气越多,速率越快, 4~5 min最小,因为H+ 浓度小 2~3 min速率最大。由图可知3X+Y 2Z,V(HCL)= 0.025mol/(L•min) ,为了减缓反应速率而又不减少产生氢气的量,加水或者.加NaCl溶液 都是改变氢离子的浓度,加碳酸钠溶液会消耗氢离子,加NaNO3溶液会改变反应不再产生氢气。

(12分)化学反应速率与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 50 | 120 | 232 | 288 | 310 |
原因是 。
②哪一时间段的反应速率最大 ,原因是 。
③求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率 。
(设溶液体积不变)
④如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他可采取的措施是 :
A.加蒸馏水 B.加Na2CO3溶液 C.加NaCl溶液 D.加NaNO3溶液
(2)已知某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。该反应的化学方程式为: 。
(12分)化学反应速率与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
|
时间(min) |
1 |
2 |
3 |
4 |
5 |
|
氢气体积(mL)(标准状况) |
50 |
120 |
232 |
288 |
310 |
① 哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最小 ,
原因是 。
② 哪一时间段的反应速率最大 ,原因是 。
③ 求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率 。
(设溶液体积不变)
④ 如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他可采取的措施是 :
A.加蒸馏水 B.加Na2CO3溶液 C.加NaCl溶液 D.加NaNO3溶液
(2)已知某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。该反应的化学方程式为: 。
 pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).
pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).