题目内容
7.如表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.| A | B | ||||||
| D | E | F | |||||
| C | I | G | H |
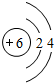
(2)稳定性比较:D的氢化物>G的氢化物(填“大于”“等于”或“小于)
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为
(4)现有上表中所列字母代表的某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,写出有关的离子方程式Cl+H2O=H++Cl-+HClO
(5)“神舟”七号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,该物质应该是由上表中的元素组成的,用化学方程式表示吸收原理:2Na2O2+2CO2═2Na2CO3+O2飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为N≡N.
分析 根据元素在周期表中的相对位置可知,A为H元素、B为He、C为Na、D为C、E为N、F为O、G为Si、H为Cl元素,
(1)有机物中都含有C原子,所以碳元素形成的化合物种类最多;
(2)非金属性越强,对应气态氢化物的稳定性越强,根据二者的非金属性判断;
(3)A为H、E为N,二者形成的极易溶于水的化合物为氨气,氨气为共价化合物,分子中存在3个氮氢键,据此写出其电子式;
(4)氯气与水反应生成氯化氢和次氯酸,所以氯水显示酸性,同时生成的次氯酸具有漂白性;
(5)过氧化钠和二氧化碳反应生成氧气,过氧化钠可以做呼吸的供氧剂.
解答 解:根据元素在周期表中的相对位置可知,A为H元素、B为He、C为Na、D为C、E为N、F为O、G为Si、H为Cl元素,
(1)上述元素A、B、D、E、F中形成化合物种类最多的一种元素为C元素,C的原子序数为6,其原子结构示意图为: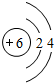 ,
,
故答案为: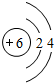 ;
;
(2)D的氢化物为甲烷,G的氢化物硅烷,非金属性:C>Si,非金属性越强,对应的气态氢化物越稳定,则气态氢化物D的氢化物>G的氢化物,
故答案为:>;
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物为氨气,氨气为共价化合物,氨气电子式为: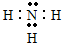 ,
,
故答案为;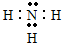 ;
;
(4)现有上表中所列字母代表的某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,该单质为氯气,氯气与水反应生成氯化氢和次氯酸,反应的离子方程式为:Cl+H2O=H++Cl-+HClO,
故答案为:Cl+H2O=H++Cl-+HClO;
(5)过氧化钠和二氧化碳反应生成氧气,反应的化学方程式为:2Na2O2+2CO2═2Na2CO3+O2;为稀释氧气,制造一种适合宇航员生存的人工生态环境,可以在飞船中加氮气,制造类似空气的环境,氮气的结构式为:N≡N,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;N≡N.
点评 本题考查元素周期表与元素周期律的综合应用,题目难度中等,熟悉元素在周期表中的位置并推出元素是解答本题的关键,并熟悉元素及其单质、化合物的性质即可解答.

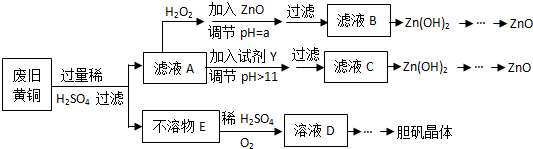
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
(1)加入ZnO调节pH=a的目的是使溶液中的Fe3+完全沉淀,Zn2+不被沉淀,a的范围是3.0≤a<5.9.
(2)由不溶物E生成溶液D的化学方程式为2Cu+O2+2H2SO4=2CuSO4+2H2O.
(3)滤液A中加入H2O2反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)由溶液D制胆矾晶体包含的主要操作步骤是蒸发浓缩、冷却结晶、过滤.
(5)下列试剂可作为Y试剂的是B.
A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是先产生白色沉淀后沉淀溶解.
| A. | 二氧化氮中混有一氧化氮杂质,可通入氧气将一氧化氮转化为二氧化氮 | |
| B. | 过量的铜与浓硝酸反应一定有一氧化氮生成 | |
| C. | Fe与S混合加热生成FeS2 | |
| D. | 工业上利用氨气制硝酸属于人工固氮 |
| A. | SO2与Si02 | B. | CCl4与KCl | C. | NaCl与HCl | D. | HNO3与H20 |
| A. | 4种 | B. | 8种 | C. | 12种 | D. | 16种 |
| A. | 它是氧化物 | |
| B. | 含有K、Cr、O三种元素 | |
| C. | 钾、铬、氧三种元素的质量比为 39:52:112 | |
| D. | 重铬酸钾是由2个钾原子、2个铬原子、7个氧原子构成 |
(1)工业上利用CO2和H2反应合成甲醇.已知25℃.101kPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ•mol-1
CH2OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H20(g)△H2=-676kJ•mol-1
①写出CO2和H2反应生成CH2OH(g)与H2O(g)的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50kJ/mol
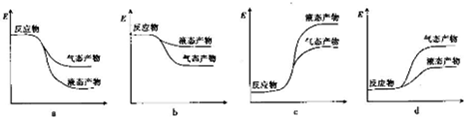
②下列表示该合成甲醇反应的能量变化示意图中正确的是a(填字母)
③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)=H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,则达到平衡时H2O的转化率为33.3%
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)=CH2OH(g)△H=-90.1kJ•mol-1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质浓度(mol•L-1)变化如下表所示(前6min没有改变条件)
| 2min | 4min | 6min | 8min | ′′′ | |
| CO | 0.07 | 0.06 | 0.04 | 0.05 | ′′′ |
| H2 | x | 0.12 | 0.12 | 0.2 | ′′′ |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | ′′′ |
②若6~8min时只改变了一个条件,则改变的条件是增加了1 mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”)
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性;
Ⅱ温度低,反应速率慢,单位时间内的产量低;而该反应为放热反应,温度过高,转化率降低
(3)甲醇在催化剂条件下可以直接氧化成甲酸,在常温下,20.00mL,0.1000mol•L-1NaOH溶液与等体积、等浓度甲酸溶液混合后所得溶液的pH>7(填“<”“>”或“=”)原因是HCOO-+H2O?HCOOH+OH-(用离子方程式表示)