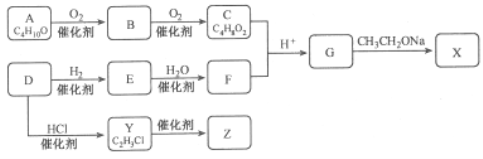
题目内容
【题目】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是____ ,X和Y中电负性较大的是_____(填元素符号)。
(2)X的氢化物的沸点_____(填“>”或“<”)与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是_________(填离子符号)。
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是____________。
【答案】 [Ne]3s1 Cl>S H2O>H2S 水中有氢键,增大了分子间作用力 平面正三角形 Na+ K2Cr2O7+3H2O2+4H2SO4=Cr2(SO4)3+K2SO4+7H2O
【解析】根据题意知M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层p轨道数是s轨道电子数的2倍,则M是O元素;R是同周期元素中最活泼的金属元素,则R是Na元素;X和M形成的一种化合物是形成酸雨的主要大气污染物,则X是S元素,Y为Cl元素;Z的基态原子4s和3d轨道半充满,即价电子排布式为3d54s1,Z是Cr元素,据此作答。(1)R是Na元素,原子序数为11,根据构造原理确定其基态原子的电子排布式为1s22s22p63s1或[Ne]3s1;S和Cl比较电负性较大的是Cl元素;(2)H2S的沸点低于H2O的主要原因是水分子间形成氢键,使水的沸点升高,答案为:H2S分子间不存在氢键,H2O分子间存在氢键;(3)SO3中硫原子的价层电子对为![]() =3,没有孤电子对,硫原子的杂化方式为sp2,该分子的空间构型为平面三角形;(4)根据晶胞结构可以算出白球的个数为8×
=3,没有孤电子对,硫原子的杂化方式为sp2,该分子的空间构型为平面三角形;(4)根据晶胞结构可以算出白球的个数为8×![]() +6×
+6×![]() =4,黑球的个数为8个,由于这种离子化合物的化学式为Na2O,黑球代表的是Na+;(5)根据题意知重铬酸钾被还原为Cr3+,则过氧化氢被氧化生成氧气,利用化合价升降法配平,反应的化学方程式为:K2Cr2O7+3H2O2+ 4H2SO4= K2SO4+Cr2(SO4)3+3O2↑+7H2O。
=4,黑球的个数为8个,由于这种离子化合物的化学式为Na2O,黑球代表的是Na+;(5)根据题意知重铬酸钾被还原为Cr3+,则过氧化氢被氧化生成氧气,利用化合价升降法配平,反应的化学方程式为:K2Cr2O7+3H2O2+ 4H2SO4= K2SO4+Cr2(SO4)3+3O2↑+7H2O。

【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。已知N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4 kJ·mol-1.下列说法正确的是( )
2NH3(g)ΔH=-92.4 kJ·mol-1.下列说法正确的是( )
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓度 | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A. 2c1 = c3 B. a+b = 92.4 C. 2p2 = p3 D. α1+α3 = 1