题目内容
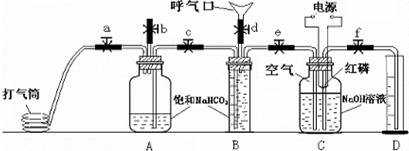
 某课外小组利用如图装置进行相关实验,请回答下列问题.
某课外小组利用如图装置进行相关实验,请回答下列问题.(1)仪器D在实验中的作用是
(2)若将A容器中的液体逐滴加人到B容器的固体中,产生气体,该气体可以是(填化学式,写出2种即可)
(3)若 A中装有浓盐酸,B中装有高锰酸钾固体,C容器中装有淀粉碘化钾溶液,旋开E后,一段时间C中溶液变蓝色,写出B中发生反应的化学方程式
(4)工业上用电解饱和氯化钠溶液的方法制取氯气,写出该反应的离子方程式
分析:(1)依据仪器D装置的特点:干燥管下端刚没入液体内解答;为确保实验能够顺利进行,制取气体的装置要检查气密性;
(2)依据发生装置的特点:没有酒精灯,分液漏斗盛放液体,圆底烧瓶盛放液体或固体,结合常见气体反应原理解答;
(3)通过C容器中装有淀粉碘化钾溶液,旋开E后,一段时间C中溶液变蓝色,说明浓盐酸与高锰酸钾反应生成了氯气;浓盐酸在反应中既表现还原性又表现酸性,表现还原性的占参加反应盐酸的
,结合反应方程式计算氯气的体积;
(4)电解饱和食盐水生成氯化钠、氢气和氯气.
(2)依据发生装置的特点:没有酒精灯,分液漏斗盛放液体,圆底烧瓶盛放液体或固体,结合常见气体反应原理解答;
(3)通过C容器中装有淀粉碘化钾溶液,旋开E后,一段时间C中溶液变蓝色,说明浓盐酸与高锰酸钾反应生成了氯气;浓盐酸在反应中既表现还原性又表现酸性,表现还原性的占参加反应盐酸的
| 10 |
| 16 |
(4)电解饱和食盐水生成氯化钠、氢气和氯气.
解答:解:(1)仪器D,干燥管下端刚没入液面以下,且干燥管中间容积较大,能很好的防治倒吸的发生,所以仪器D的作用是防止溶液倒吸;实验开始之前应进行的第一项操作是:检查整套装置气密性,
故答案为:防止溶液倒吸;检查整套装置气密性;
(2)该装置可制取的气体的条件是反应物为固体和液体,反应条件不加热,实验室制备二氧化碳的原理:CaCO3+2 HCl=CaCl2+CO2↑+H2O,实验室制备氧气的反应原理:2H2O2
2H2O+O2↑,实验室制备氢气反应原理:Zn+H2SO4=H2↑+ZnSO4,所以可以制备的气体:CO2 H2 O2;
故答案为:CO2 H2 O2 ;
(3)高锰酸钾与浓盐酸反应的化学方程式:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;
根据方程式可知当有2mol氯化氢被氧化时,生成1mol氯气,则当有1.6mol浓盐酸被氧化时,生成的氯气的物质的量为:0.8mol,其体积为:0.8mol×22.4L/mol=17.92L,即17920ml,
故答案为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;17920ml;
(4)电解饱和食盐水的离子方程式为:2Cl-+2H2O
2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑.
故答案为:防止溶液倒吸;检查整套装置气密性;
(2)该装置可制取的气体的条件是反应物为固体和液体,反应条件不加热,实验室制备二氧化碳的原理:CaCO3+2 HCl=CaCl2+CO2↑+H2O,实验室制备氧气的反应原理:2H2O2
| ||
故答案为:CO2 H2 O2 ;
(3)高锰酸钾与浓盐酸反应的化学方程式:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;
根据方程式可知当有2mol氯化氢被氧化时,生成1mol氯气,则当有1.6mol浓盐酸被氧化时,生成的氯气的物质的量为:0.8mol,其体积为:0.8mol×22.4L/mol=17.92L,即17920ml,
故答案为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;17920ml;
(4)电解饱和食盐水的离子方程式为:2Cl-+2H2O
| ||
故答案为:2Cl-+2H2O
| ||
点评:本题考查了气体制备发生装置的选择,氯气的实验室和工业制法,题目难度中等,熟悉气体制备的反应原理是发生装置选择的关键,注意浓盐酸与高锰酸钾反应中表现的性质.

练习册系列答案
相关题目
 某课外兴趣小组为探究某种铝合金(含Mg Al)中铝含量,设计如图装置进行实验.
某课外兴趣小组为探究某种铝合金(含Mg Al)中铝含量,设计如图装置进行实验.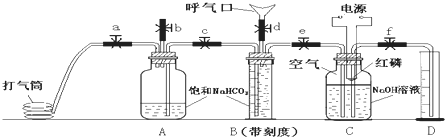
 Ⅱ.某课外活动小组利用如图装
Ⅱ.某课外活动小组利用如图装 Ⅱ.某课外活动小组利用如图装
Ⅱ.某课外活动小组利用如图装