��Ŀ����
������ȷ��ʾ���з�Ӧ�����ӷ���ʽ�ǣ� ��
A��Na��ϡ���ᷴӦ�����ӷ���ʽΪ2Na+2H+�T2Na++H2��
B��Na2O2����ˮ����O2��2Na2O2+2H2O�T4Na++4OH��+O2��
C��̼�������Һ�еμ�����������Һ��Ca2+ǡ����ȫ������Ca2++HCO3��+OH��=CaCO3��+H2O
D������̼������Һ��ͨ�����������̼���壺CO32��+CO2+H2O=2HCO3��
��ϰ��ϵ�д�
 ���㼤�������100�ִ��Ծ�ϵ�д�
���㼤�������100�ִ��Ծ�ϵ�д�
�����Ŀ
20����������ʵ��ܽ�ȼ��㱥����Һ�����ʵ���Ũ�ȣ����������бز����ٵ��ǣ�������
���ܶ�
�����
�����ʵ�Ħ������
�����ʺ��ݼ��������ȣ�
���ܶ�
�����
�����ʵ�Ħ������
�����ʺ��ݼ��������ȣ�
| A�� | �٢� | B�� | �ڢ� | C�� | �٢� | D�� | �ڢ� |
1��������Ҫ��ս��Ԫ�أ��ڵؿ��к�����Ϊ0.007%���ҹ��ٴ���Լռ�����ܴ�����55%������λ���Ӿ���Ԥ�������ٿ�ԭ�ϣ���Ҫ�ɷ�FeWO4��MnWO4������Si��P��As�Ļ�����ȣ��Ʊ�WO3���������£�
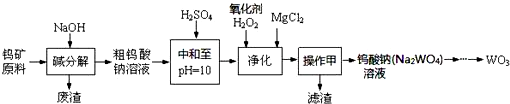
�ش��������⣺
��1�����������в����������ǹ��ˣ�
��2���ٿ�ԭ�ϡ���ֽ⡱ʱ�Ľ�������ԭ���е�CaO������NaOHŨ�ȡ��������ȶ��й�ϵ�����±���ʾ������˵����ȷ����A��
�ٿ�ԭ�ϼ�ֽ�ʱ�Ľ�������NaOHŨ�ȵ�����Ӱ��Ĺ�ϵͼ
ע���������ĵ�λΪ�������ı���
A������NaOHŨ�Ƚ��������������������� B�����������������һ������
C�����������������һ����С�������������� D��ԭ����CaO�ĺ������������������
��3��pH=10����Һ�к��е�������������SiO32-��HAsO32-��HAsO42-��HPO42-�ȣ�������ʱ������H2O2��Ӧ�����ӷ���ʽHAsO32-+H2O2=HAsO42-+H2O��
��4���ڡ��������Σ���������������ҺpH=9.5��Ϊ������Mg��OH��2��������Һ��c��Mg2+��Ӧ������5.6��10-3mol•L-1��[Ksp��Mg��OH��2=5.6��10-12]
��5���������������õIJ�Ʒ�����Ϻã����з����ų����ų��ķ�ˮ�к��е���Ҫ������Na2SO4��NaCl���ѧʽ����
��6�������Խ����е�̼���٣�WC�������������������Դ�̼���ٷ����л����٣����ʱ����̼������������������������������������Ტ�ų�����Ⱦ�����壮��������ӦʽΪWC+6H2O-10e-=H2WO4+CO2��+10H+��

�ش��������⣺
��1�����������в����������ǹ��ˣ�
��2���ٿ�ԭ�ϡ���ֽ⡱ʱ�Ľ�������ԭ���е�CaO������NaOHŨ�ȡ��������ȶ��й�ϵ�����±���ʾ������˵����ȷ����A��
�ٿ�ԭ�ϼ�ֽ�ʱ�Ľ�������NaOHŨ�ȵ�����Ӱ��Ĺ�ϵͼ
| w��CaO��% NaOHŨ��& ������% ������c/mol•L-1 | 0.1 | 1.3 | 1.3 | 2.7 |
| 30 | 30 | 40 | 40 | |
| 1.1 | 99.1 | 90.1 | 93.3 | 83.2 |
| 1.3 | 99.4 | 92.7 | 93.0 | 82.1 |
| 1.5 | 99.5 | 93.4 | 96.5 | 83.0 |
A������NaOHŨ�Ƚ��������������������� B�����������������һ������
C�����������������һ����С�������������� D��ԭ����CaO�ĺ������������������
��3��pH=10����Һ�к��е�������������SiO32-��HAsO32-��HAsO42-��HPO42-�ȣ�������ʱ������H2O2��Ӧ�����ӷ���ʽHAsO32-+H2O2=HAsO42-+H2O��
��4���ڡ��������Σ���������������ҺpH=9.5��Ϊ������Mg��OH��2��������Һ��c��Mg2+��Ӧ������5.6��10-3mol•L-1��[Ksp��Mg��OH��2=5.6��10-12]
��5���������������õIJ�Ʒ�����Ϻã����з����ų����ų��ķ�ˮ�к��е���Ҫ������Na2SO4��NaCl���ѧʽ����
��6�������Խ����е�̼���٣�WC�������������������Դ�̼���ٷ����л����٣����ʱ����̼������������������������������������Ტ�ų�����Ⱦ�����壮��������ӦʽΪWC+6H2O-10e-=H2WO4+CO2��+10H+��
18����������������Ʒ���ǣ�������
| A�� | ������̥ | B�� | ���� | C�� | ����ϩ��Ʒ | D�� | ������ |


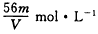 B��
B��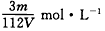 C��
C��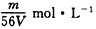 D��
D��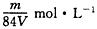
 ��Ӧ��ϵ�й����������ʣ�NH4Cl��
��Ӧ��ϵ�й����������ʣ�NH4Cl�� FeCl3��N2��Fe2O3��Fe��X��
FeCl3��N2��Fe2O3��Fe��X��