��Ŀ����
����16�֣�������������ͼ�ǽṹ��ʽΪCH3CH2CH2OH��CH3CH(OH)CH3�������л��������1H�˴Ź�����ͼ�����ж���һ����CH3CH(OH)CH3��1H��NMR��ͼ����˵�����ɡ���6�֣�
�ڡ�0.2 mol�л����0.4 mol O2���ܱ�������ȼ�պ�IJ���ΪCO2��CO��H2O��g����ȼ�պ����Щ���ᆳ��ŨH2SO4����������10.8 g����ͨ�����ȵ�CuO��ַ�Ӧ������������3.2 g�����������ͨ����ʯ�ұ���ȫ���գ���������17.6 g���������õ������ԭ������H-1��C-12��O-16��Cu-64��
��1���ƶϸ��л���ķ���ʽ����6�֣�
��2����0.2 mol���л�����������Ľ�������ȫ��Ӧ��ų�4.48 L H2����״��������ȷ���л���Ľṹ��ʽ����4�֣�?
��A��3�֣����ɣ��ӽṹ�Ϸ�����CH3CH(OH)CH3�����ֲ�ͬ��ѧ������H����CH3CH2CH2OH�����ֲ�ͬ��H���ʴ�ͼ�Ϸ�����A���������壬��B���ĸ��壬��A��CH3CH(OH)CH3��1H��NMR��ͼ��3�֣���
�ڣ�1��Ũ�������ӵ���������ˮ������������ˮ��10.8g�����ʵ�����0.6mol��COͨ�����ȵ�����ͭ�ֱ���������CO2�������л�����ȫȼ�ղ�����CO2��17.6g�����ʵ�����0.4mol�����ݷ���ʽCO��CuO Cu��CO2��֪��ÿ����1molCO�����������ͼ���16g������CO�����ʵ�����3.2��16��0.2mol�����л���ȼ����������0.2CO2��0.2molCO��0.6molˮ�����Ը���ԭ���غ��֪�л�������ԭ�ӵ����ʵ�����0.4mol+0.2mol+0.6mol-0.4mol��2��0.4mol������л�������ʽΪCH3O����Ϊ2��̼ԭ�������6����ԭ�ӣ����Ի�����ķ���ʽΪC2H6O2.
Cu��CO2��֪��ÿ����1molCO�����������ͼ���16g������CO�����ʵ�����3.2��16��0.2mol�����л���ȼ����������0.2CO2��0.2molCO��0.6molˮ�����Ը���ԭ���غ��֪�л�������ԭ�ӵ����ʵ�����0.4mol+0.2mol+0.6mol-0.4mol��2��0.4mol������л�������ʽΪCH3O����Ϊ2��̼ԭ�������6����ԭ�ӣ����Ի�����ķ���ʽΪC2H6O2.
��2����״����4.48L���������ʵ�����0.2mol����Ϊ2���ǻ�������1���������������л������ǻ��ĸ�����2����������Ҷ������ṹ��ʽΪHOCH2CH2OH��
����

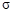 ����
����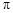 ���ĸ�����Ϊ
���ĸ�����Ϊ 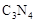 �γɵ�ԭ�Ӿ��壬�ṹ����
�γɵ�ԭ�Ӿ��壬�ṹ����
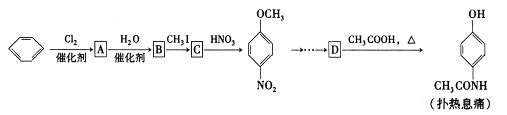
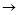 C�ķ�Ӧ����Ϊ ��D�й����ŵ�����Ϊ ��
C�ķ�Ӧ����Ϊ ��D�й����ŵ�����Ϊ ��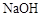 ��Һ��Ӧ������������
��Һ��Ӧ������������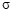 ����
����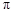 ���ĸ�����Ϊ
���ĸ�����Ϊ 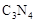 �γɵ�ԭ�Ӿ��壬�ṹ����
�γɵ�ԭ�Ӿ��壬�ṹ����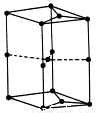

 C�ķ�Ӧ����Ϊ ��D�й����ŵ�����Ϊ ��
C�ķ�Ӧ����Ϊ ��D�й����ŵ�����Ϊ ��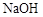 ��Һ��Ӧ������������
��Һ��Ӧ������������