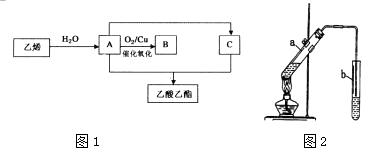
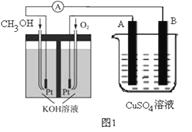
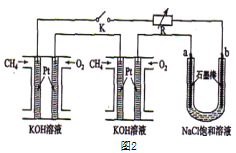
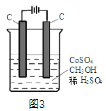
��Ŀ����
����Ŀ����14�֣�ij�����������̿���п����Ҫ�ɷ�ΪMnO2��ZnS�����������FeS��CuS��Al2O3�����ʣ�Ϊԭ����ȡZn��MnO2��
��1����һ�������£��������ֿ����������Һ������ã���ƽ���µĻ�ѧ����ʽ��
MnO2 + FeS + H2SO4![]() MnSO4 + Fe2(SO4)3 + S + H2O
MnSO4 + Fe2(SO4)3 + S + H2O
��2�������ú���Mn2+��Fe3+��Cu2+��Al3+��Zn2+��������Һ�����µĹ�ҵ���̽��в�����������Һ��IV���������Һ��IV������MnO2��Zn��
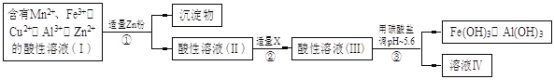
a���������м�Zn�ۺ�����Ӧ�����ӷ���ʽΪ ��
b���������м�������X��������ʲô ��X����ѡ��Ļ�ѧʽ�� ��
c��������������̼���εĻ�ѧʽ�� ��
��3��Ϊ�˴����������в�����Fe(OH)3��Al(OH)3����������л���Al(OH)3��������������µ��й�����ͼ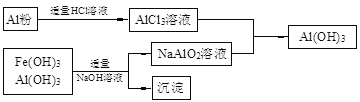
a��AlCl3��Һ��NaAlO2��Һ��Ӧ����AI(OH)3�����ӷ���ʽΪ �����ܹ��õ�n molAl(OH)3�������ĵ�NaOH��HCl����������mol���ֱ�Ϊ �� ��
b����ʹ���������̻��մ�������Ƚ�����������������������
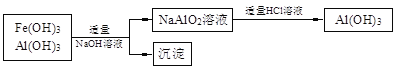
���𰸡���1��3 MnO2 + 2 FeS + 6H2SO4== 3 MnSO4 + 1 Fe2(SO4)3 + 2 S + 6 H2O (2��)
��2��a��Zn + 2Fe3+==Zn2+ + 2Fe2+��Zn + Cu2+==Zn2+ + Cu (2��)
b����Fe2+������Fe3+MnO2(2��)
c��MnCO3��ZnCO3��MnCO3��ZnCO3(2��)
��3��a��Al3++ 3AlO2��+ 6H2O==4Al(OH)3�� (2��)![]()
![]() (2��)
(2��)
b���簴�����̣���õ�ͬ��n molAl(OH)3�����ĵ�NaOH��HCl���������ֱ�Ϊn mol������ǰ���̵�����������Զ��ԣ�ǰ���̸����Ͻ�Լ��ԭ��(2��)
�������������������1����һ�������£��������ֿ����������Һ������ã�����ԭ���غ㡢�����غ�ɵ���ƽ�Ļ�ѧ����ʽ��3MnO2 + 2FeS +6H2SO4==3MnSO4 + Fe2(SO4)3 +2S + 6H2O��a�������������Һ�м���Zn�ۺ���Һ�е�Fe3+��Cu2+����Zn����������ԭ��Ӧ��������Ӧ�����ӷ���ʽΪZn + 2Fe3+==Zn2+ + 2Fe2+��Zn + Cu2+==Zn2+ + Cu������ͼʾ��֪��������Һ���к���Fe2+��Al3+�ȣ�Ҫ�����Ƿ�Ӧת��ΪAl(OH)3��Fe(OH)3������Ӧ���ȼ���������������Һ�е�Fe2+����ΪFe3+��Ϊ�˲������µ��������ӣ������������������MnO2��c��������������̼���ξ��ǵ�����Һ������Եģ����ݳ��ӵ�ԭ������Ӧ���ǵĻ�ѧʽ��MnCO3��ZnCO3����3��a��AlCl3��Һ��NaAlO2��Һ��Ϸ����ε�˫ˮ�ⷴӦ����AI(OH)3���÷�Ӧ�����ӷ���ʽΪAl3++ 3AlO2��+ 6H2O==4Al(OH)3��������n(Al3+)��n(AlO2��)=1:3,�������ܹ��õ�n molAl(OH)3������Ҫ����AlCl3�����ʵ�����n/4mol������NaAlO2�����ʵ�����3n/4mol������Ԫ���غ��֪n(NaOH)=n(NaAlO2)= 3n/4mol��n(HCl)=3n(AlCl3)= 3n/4mol��b����ʹ���������̻��մ������õ�ͬ��n molAl(OH)3�����ĵ�NaOH��HCl���������ֱ�Ϊn mol������ǰһ�������������������������Զ��ԣ�ǰ���̸����Ͻ�Լ��ԭ��

����Ŀ���±�ΪԪ�����ڱ���һ���֣�
̼ | �� | Y | |
X | �� | Z |
��ش���������:
��1��ZԪ�������ڱ��е�λ��Ϊ________________��
��2������Ԫ��ԭ�Ӱ뾶�����ǣ�дԪ�ط��ţ�________________��
��3��������ʵ��˵��YԪ�صķǽ����Ա���Ԫ�صķǽ�����ǿ����________������ţ���
a��Y������H2S��Һ��Ӧ����Һ�����
b����������ԭ��Ӧ�У�1molY���ʱ�1mol��õ��Ӷ�
c��Y������Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸ�
��4������һ������ͭ��һ��Ũ�ȵ����������Ļ���ᷴӦ�����ɵ���ֻ������ͭ��ͬʱ���ɵ�������������ϱ�������Ԫ����ɣ��������Է���������С��50��Ϊ��ֹ��Ⱦ����������������ȫת��Ϊ��ۺ������Σ�����1L2.2mol��L��1 NaOH��Һ��1molO2������������ķ���ʽ�����ʵ����ֱ�Ϊ______________________________����������ͭ���ʵ���Ϊ_______________________��