题目内容
在一定条件下,将金属钠与氧气反应的生成物7.0g溶于水,所得溶液恰好被100g 质量分数为9.8%的硫酸溶液完全中和,则该氧化物的成分为( )
| A、Na2O | B、Na2O2 | C、Na2O和Na2O2 | D、NaO2和Na2O2 |
分析:由于不知道产物是 Na2O还是Na2O2,或者二者都有,因此设定一个化学式Na2OX,算出摩尔质量,与两种氧化物的对比即可判断.
解答:解:n(硫酸)=
=0.1mol,
溶液恰好能被100g 质量分数为9.8%的硫酸溶液中和,
则 Na2OX ~2NaOH~H2SO4
0.1mol 0.1mol
则Na2OX平均摩尔质量M=
=70g/mol,介于Na2O(62g/mol)和Na2O2(78g/mOl)之间,因此,一定条件下钠与氧气反应的生成物是Na2O 和Na2O2,
故选C.
| 100g×9.8% |
| 98g/mol |
溶液恰好能被100g 质量分数为9.8%的硫酸溶液中和,
则 Na2OX ~2NaOH~H2SO4
0.1mol 0.1mol
则Na2OX平均摩尔质量M=
| 7.0g |
| 0.1mol |
故选C.
点评:本题主要考查的钠与氧气反应产物的判断,若用极限法计算,计算比较繁琐,而用平均摩尔质量来求,则比较简单.

练习册系列答案
相关题目
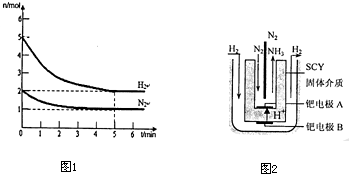
 2NH3(g)的△H= 。
2NH3(g)的△H= 。 积分数为 。
积分数为 。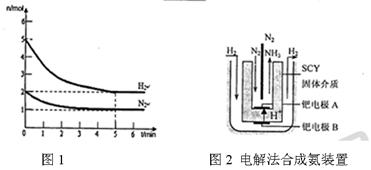
 内外
内外 上发生的电极反应式是 。
上发生的电极反应式是 。 
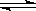 2NH3(g)的△H=_________________。
2NH3(g)的△H=_________________。