题目内容
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.在0 ℃时,22.4 L氢气中含有2NA个氢原子
B.电解食盐水若产生2 g氢气,则转移的电子数目为NA
C.1 mol乙烷分子中共价键总数为7NA
D.密闭容器中46 g NO2含有的分子数为NA
C
【解析】A项不是标准状况下,无法求算,错误;根据2NaCl+2H2O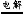 2NaOH+Cl2↑+H2↑分析可知,若产生2 g H2,即1 mol,需转移电子数为2NA,B项错误;根据乙烷的结构简式为CH3CH3,可知1 mol分子中共价键数为7NA,C项正确;在密闭容器中存在平衡2NO2
2NaOH+Cl2↑+H2↑分析可知,若产生2 g H2,即1 mol,需转移电子数为2NA,B项错误;根据乙烷的结构简式为CH3CH3,可知1 mol分子中共价键数为7NA,C项正确;在密闭容器中存在平衡2NO2 N2O4,故46 g NO2即1 mol,其含有的分子数小于NA,D项错误。
N2O4,故46 g NO2即1 mol,其含有的分子数小于NA,D项错误。

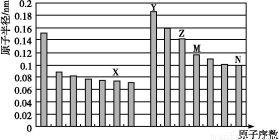
(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如下表:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
X | 578 | 1 817 | 2 745 | 11 578 |
Y | 738 | 1 451 | 7 733 | 10 540 |
Z | 496 | 4 562 | 6 912 | 9 543 |
则X、Y、Z的电负性从大到小的顺序为 (用元素符号表示),元素Y的第一电离能大于X的第一电离能的原因是
。
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小。D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C三原子都采取sp3杂化。
①A、B、C的第一电离能由小到大的顺序为 (用元素符号表示)。
②M是含有 键的 分子(填“极性”或“非极性”)。
③N是一种易液化的气体,请简述其易液化的原因:
。
④W分子的VSEPR模型的空间构型为 ,W分子的空间构型为 。
⑤AB-中和B2分子的π键数目比为 。
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4s1。
①E元素组成的单质的晶体堆积模型为 (填字母)。
a.简单立方堆积b.体心立方堆积
c.六方最密堆积d.面心立方最密堆积
②F元素在其化合物中最高化合价为 。
③G2+的核外电子排布式为 ,G2+和N分子形成的配离子的结构式为 。
苯甲酸广泛应用于制药和化工行业。某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:
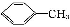 +2KMnO4
+2KMnO4
 +KOH+
+KOH+
2MnO2↓+H2O
 +HCl
+HCl
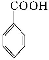 +KCl
+KCl
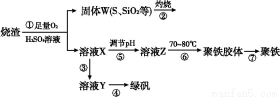
实验方法:一定量的甲苯和KMnO4溶液在100 ℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
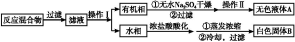
已知:苯甲酸分子量122,熔点122.4 ℃,在25 ℃和95 ℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为 ,操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是 。
(3)测定白色固体B的熔点,发现其在115 ℃开始熔化,达到130 ℃时仍有少量不熔。该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请完成表中内容。
序号 | 实验方案 | 实验现象 | 结论 |
① | 将白色固体B加入水中,加热溶解, | 得到白色晶体和无色滤液 |
|
② | 取少量滤液于试管中, | 生成白色沉淀 | 滤液含Cl- |
③ | 干燥白色晶体, |
| 白色晶体 是苯甲酸 |
(4)纯度测定:称取1.220 g产品,配成100 mL甲醇溶液,移取25.00 mL溶液,滴定,消耗KOH的物质的量为2.40×10-3 mol。产品中苯甲酸质量分数的计算表达式为 ,计算结果为 (保留二位有效数字)。