题目内容
下列反应中氧化剂与还原剂的物质的量之比为1:2,且电子转移数为0.1mol的是
- A.已知:Cu+2Fe3+=2Fe2++Cu2+.将6.4gCu片放入0.1mol/L的FeCl3溶液中充分反应
- B.R2O82-离子在一定条件下可以把Mn2+氧化成MnO4-,而R2O82-离子变为RO42-,若得到的溶液中含MnO4-0.2mol
- C.C1O2是一种杀菌、消毒、效率高、二次污染小的水处理剂.实验室制备原理:2KClO3+H2C2O4+H2SO4
 2ClO2↑+K2SO4+2CO2↑+2H2O,标况下制得气体为1.12L
2ClO2↑+K2SO4+2CO2↑+2H2O,标况下制得气体为1.12L - D.臭氧可使湿润的KI淀粉试纸变蓝,其原理为:O3+2KI+H2O=2KOH+I2+O2,测得1000mL溶液中的pH=13
D
分析:根据元素的化合价变化来分析氧化剂及还原剂,利用化学反应方程式来分析氧化剂与还原剂的物质的量之比,并利用得电子数等于失去电子数等于转移的电子总数来分析;
解答:A、氧化剂为Fe3+,还原剂为Cu,故氧化剂与还原剂的物质的量之比为2:1,6.4gCu失去电子数为0.2mol,则电子转移数也为0.2mol,故A错误;
B、每1mol氧化剂R2O82-变为RO42-得到2mol电子,每1mol还原剂Mn2+氧化成MnO4-时得到5mol电子,所以氧化剂与还原剂物质的量之比为5:2,生成MnO4-0.2mol,转移的电子数为1mol,故B错误;
C、氧化剂为KClO3,还原剂为H2C2O4,氧化剂与还原剂物质的量之比为2:1,得到的气体为0.05mol,其中ClO2为0.025mol,转移的电子数为0.025mol,故C错误;
D、氧化剂为O3,还原剂为KI,氧化剂与还原剂物质的量之比为1:2,由方程式可知生成2molKOH转移的电子数为2mol,生成的KOH为1.0×0.1mol/L=0.1mol,则转移的电子数为0.1mol,故D正确;
故选D.
点评:本题考查氧化还原反应中氧化剂及还原剂的分析,并利用化合价的变化来分析转移的电子数,明确化学反应中化合价的变化是解答的关键.
分析:根据元素的化合价变化来分析氧化剂及还原剂,利用化学反应方程式来分析氧化剂与还原剂的物质的量之比,并利用得电子数等于失去电子数等于转移的电子总数来分析;
解答:A、氧化剂为Fe3+,还原剂为Cu,故氧化剂与还原剂的物质的量之比为2:1,6.4gCu失去电子数为0.2mol,则电子转移数也为0.2mol,故A错误;
B、每1mol氧化剂R2O82-变为RO42-得到2mol电子,每1mol还原剂Mn2+氧化成MnO4-时得到5mol电子,所以氧化剂与还原剂物质的量之比为5:2,生成MnO4-0.2mol,转移的电子数为1mol,故B错误;
C、氧化剂为KClO3,还原剂为H2C2O4,氧化剂与还原剂物质的量之比为2:1,得到的气体为0.05mol,其中ClO2为0.025mol,转移的电子数为0.025mol,故C错误;
D、氧化剂为O3,还原剂为KI,氧化剂与还原剂物质的量之比为1:2,由方程式可知生成2molKOH转移的电子数为2mol,生成的KOH为1.0×0.1mol/L=0.1mol,则转移的电子数为0.1mol,故D正确;
故选D.
点评:本题考查氧化还原反应中氧化剂及还原剂的分析,并利用化合价的变化来分析转移的电子数,明确化学反应中化合价的变化是解答的关键.

练习册系列答案
相关题目
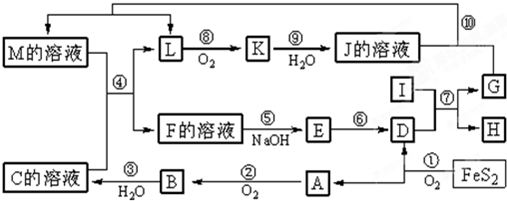
( 8分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属, K是一种红棕色气体。
|
 (提示:4FeS2+11O2
(提示:4FeS2+11O2 2Fe2O3+8SO2)
2Fe2O3+8SO2)请填写下列空白:
⑴ 在周期表中,组成单质G的元素位于第___ _ _周期_________族。
⑵ 在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
⑶ 在②、③、⑥、⑨中既属于化合反应又属于非氧化还原反应的是___________(填序号)
⑷ 反应④的离子方程式是:______________________________________________。
⑸ 将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:__________________________________。


 2Fe2O3+8SO2)
2Fe2O3+8SO2)
 2Fe2O3+8SO2)
2Fe2O3+8SO2)