题目内容
19.下列离子方程式书写正确的是( )| A. | 氧化铜与盐酸反应 O2-+2H+=H2O | |
| B. | 碳酸氢钠与氢氧化钠溶液混合:HCO3-+OH-=H2O+CO32- | |
| C. | 水垢溶解于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 小苏打溶液与稀硫酸混合:CO32-+2H+=CO2↑+H2O |
分析 A.氧化物应保留化学式;
B.二者反应生成碳酸钠和水;
C.醋酸为弱电解质,应保留化学式;
D.小苏打为碳酸氢钠,碳酸氢根离子为弱酸的酸式根离子,不能拆.
解答 解:A.氧化铜与盐酸反应生成氯化铜和水,离子方程式:CuO+2H+=H2O+Cu2+,故A错误;
B.碳酸氢钠与氢氧化钠溶液混合,离子方程式:HCO3-+OH-=H2O+CO32-,故B正确;
C.水垢溶解于醋酸,离子方程式:CaCO3+2CH3COOH=Ca2++CO2↑+H2O+2CH3COO-,故C错误;
D.小苏打溶液与稀硫酸混合,离子方程式:HCO3-+H+=CO2↑+H2O,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意化学式的拆分,注意反应必须遵循客观事实,题目难度不大.

练习册系列答案
相关题目
9.下列操作或说法中不正确的是( )
| A. | 过滤时玻璃棒与三层滤纸处接触 | |
| B. | 金属钠着火时应立即用泡沫灭火器扑灭 | |
| C. | 向待测液中加入稀硝酸酸化的硝酸银溶液,可以检验氯离子 | |
| D. | 向待测液中加入稀盐酸酸化的氯化钡溶液检验硫酸根,可能产生误差 |
10.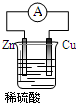 下列关于如图所示装置叙述正确的是( )
下列关于如图所示装置叙述正确的是( )
 下列关于如图所示装置叙述正确的是( )
下列关于如图所示装置叙述正确的是( )| A. | 铜片质量逐渐减小 | B. | H+在铜片表面被还原 | ||
| C. | 电流从锌片经过导线流向铜片 | D. | 铜是负极,铜片上有气泡产生 |
7.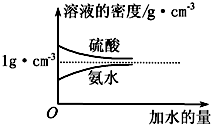 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,相关数据如表所示.
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,相关数据如表所示.
请根据表中信息,回答下列问题:
(1)表中硫酸的质量分数w1为$\frac{98{c}_{1}}{1000{ρ}_{1}}$(不写单位,用含c1、ρ1的代数式表示);
(2)物质的量浓度为c1 mol•L-1,质量分数为w1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为0.5c1mol•L-1,质量分数>$\frac{{w}_{1}}{2}$(填“>”、“<”或“=”);
(3)质量分数为w2的氨水与$\frac{{w}_{2}}{5}$的氨水等质量混合,所得溶液的密度>ρ2 g•cm-3 (填“>”、“<”或“=”);
(4)如果蒸发溶剂使硫酸的质量分数变为2w1,则所得硫酸的物质的量浓度>2c1(填“>”、“<”或“=”).
 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,相关数据如表所示.
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,相关数据如表所示.| 溶质的物质的量浓度/mol•L-1 | 溶质的质量分数 | 溶液的密度/g•cm-3 | |
| 硫酸 | c1 | w1 | ρ1 |
| 氨水 | c2 | w2 | ρ2 |
(1)表中硫酸的质量分数w1为$\frac{98{c}_{1}}{1000{ρ}_{1}}$(不写单位,用含c1、ρ1的代数式表示);
(2)物质的量浓度为c1 mol•L-1,质量分数为w1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为0.5c1mol•L-1,质量分数>$\frac{{w}_{1}}{2}$(填“>”、“<”或“=”);
(3)质量分数为w2的氨水与$\frac{{w}_{2}}{5}$的氨水等质量混合,所得溶液的密度>ρ2 g•cm-3 (填“>”、“<”或“=”);
(4)如果蒸发溶剂使硫酸的质量分数变为2w1,则所得硫酸的物质的量浓度>2c1(填“>”、“<”或“=”).
11.下列关于实验基本操作的叙述正确的是( )
| A. | 使用分液漏斗和容量瓶时,首先要洗净 | |
| B. | 蒸馏实验中,要在烧瓶中加入几粒沸石或碎瓷片,以防止液体暴沸 | |
| C. | 用蒸发皿进行加热蒸发时,一定要垫石棉网 | |
| D. | 向试管中加液体时,胶头滴管紧贴试管内壁 |
8.25℃时,在等体积的①0.5mol/L的H2SO4溶液中,②0.05mol/LBa(OH)2溶液中,③1mol/LNaCl溶液中,④纯水中发生电离的水的物质的量之比是( )
| A. | 1:10:107:107 | B. | 107:107:1:1 | C. | 107:106:2:2 | D. | 107:106:2×107:2 |
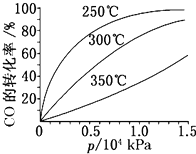 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.