题目内容
【题目】甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
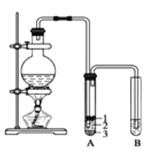
已知①常压下反应的能量变化如图所示。

②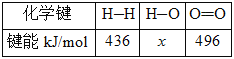
③CO(g)+1/2O2(g)===CO2(g) ΔH=-280kJ/mol
H2(g)+1/2O2(g)===H2O(l) ΔH=-284kJ/mol
H2O(l)===H2O(g) ΔH=+ 44kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式_________________________。
(2)H—O键的键能x为_________kJ/mol。
(3)甲醇气体分解为CO和H2两种气体的反应的活化能为_________kJ/mol。
(4)在________(填“高温”或“低温”)情况下有利于CO和H2制备甲醇的反应自发进行。
(5)某兴趣小组同学利用甲醇燃料电池探究电浮选法处理污水的一种方式:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH )3沉淀。Fe(OH)3具有吸附性,可吸附污物而沉积下来,具有净化水的作用。装置如右图所示。
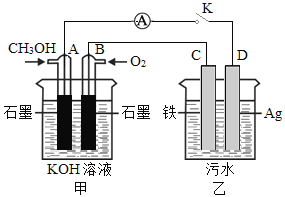
①写出甲池的A极电极反应式:______________________。
②若乙池实验时污水中离子浓度较小,导电能力较差,净水效果不好,此时应向污水中加入适量的_______。
A.H2SO4
B.BaSO4
C.Na2SO4
D.NaOH
E.CH3CH2OH
【答案】
(1)CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H=-757kJmol-1;
O2(g)=CO2(g)+2H2O(l)△H=-757kJmol-1;
(2)462;(3)510;(4)低温;
(5)①CH3OH-6e-+8OH-=CO32-+6H2O;②C。
【解析】
试题分析:(1)燃烧热的热化学方程式中,可燃物为1mol,反应生成稳定的氧化物。由图1可得热化学方程式:①CO(g)+2H2(l)=CH3OH(g)△H=-91kJ/mol,又已知:②CO(g)+![]() O2(g)═CO2(g)△H=-280kJ/mol,③H2(g)+
O2(g)═CO2(g)△H=-280kJ/mol,③H2(g)+![]() O2(g)═H2O(l)△H=-284 kJ/mol,根据盖斯定律,③×2+②-①可得:CH3OH(g)+
O2(g)═H2O(l)△H=-284 kJ/mol,根据盖斯定律,③×2+②-①可得:CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H=-757kJmol-1,故答案为:CH3OH(g)+
O2(g)=CO2(g)+2H2O(l)△H=-757kJmol-1,故答案为:CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H=-757kJmol-1;
O2(g)=CO2(g)+2H2O(l)△H=-757kJmol-1;
(2)已知:H2(g)+![]() O2(g)═H2O(l)△H=-284 kJ/mol,H2O(l)═H2O(g)△H=+44kJ/mol,二者相加可得:H2(g)+
O2(g)═H2O(l)△H=-284 kJ/mol,H2O(l)═H2O(g)△H=+44kJ/mol,二者相加可得:H2(g)+![]() O2(g)═H2O(g)△H=-240 kJ/mol,反应热=反应物总键能-生成物总键能,则436kJ/mol+
O2(g)═H2O(g)△H=-240 kJ/mol,反应热=反应物总键能-生成物总键能,则436kJ/mol+![]() ×496kJ/mol-2×x kJ/mol=-240kJ/mol,解得x=462,故答案为:462;
×496kJ/mol-2×x kJ/mol=-240kJ/mol,解得x=462,故答案为:462;
(3)根据图像,甲醇气体分解为CO和H2两种气体的反应的活化能=91 kJ/mol +419 kJ/mol =510 kJ/mol,故答案为:510;
(4)CO(g)+2H2(l)=CH3OH(g)△H=-91kJ/mol的△H<0、△S<0,△H-T△S<0反应自发进行,故在低温下反应具有自发性,故答案为:低温;
(5)①甲池的A极为负极,发生氧化反应,电极反应式为CH3OH - 6e- + 8OH- =CO32- + 6H2O,故答案为:CH3OH - 6e- + 8OH- =CO32- + 6H2O;
②A