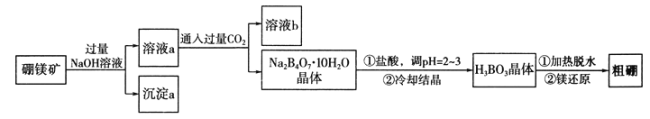
题目内容
【题目】下图为合成氨N2(g)+3H2(g)![]() 2NH3(g)反应过程中的能量变化情况,请回答下列问题:
2NH3(g)反应过程中的能量变化情况,请回答下列问题:
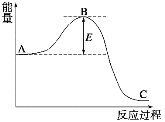
(1)反应中用活性铁作催化剂,使用活性铁会使图中B点升高还是降低________,理由是___________。
(2)该反应平衡常数为K,当浓度商Qc______K(填“<”、“>”或“=”)时,反应向右进行。
(3)400 ℃时该反应的平衡常数_______450 ℃时的平衡常数(填“<”、“>”或“=”)。
(4)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,可以采取的合理措施有(填字母)________。
A.高温高压
B.加入催化剂
C.增加N2的浓度
D.增加H2的浓度
E.分离出NH3
【答案】(1)降低(2分)催化剂能改变反应的路径,降低反应活化能(2分)
(2)<(2分)(3)>(2分)(4)CE(2分)
【解析】
试题分析:(1)催化剂能改变反应的路径,降低反应活化能,所以使用活性铁会使图中B点降低。
(2)该反应平衡常数为K,当浓度商Qc<K时,反应向右进行。
(3)反应物总能量高于生成物总能量,正反应是放热反应,因此400 ℃时该反应的平衡常数>450 ℃时的平衡常数。
(4)正反应是体积减小的放热反应,则A.高温平衡向逆反应方向减小,氢气转化率降低,A错误;B.加入催化剂平衡不移动,转化率不变,B错误;C.增加N2的浓度平衡向正反应方向进行,氢气转化率增大,C正确;D.增加H2的浓度平衡向正反应方向进行,但氢气的转化率降低,D错误;E.分离出NH3平衡向正反应方向进行,氢气转化率增大,E正确,答案选CE。

练习册系列答案
相关题目