题目内容
制备食用碘盐(KIO3)原理之一为:I2+2KClO3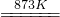 Cl2+2KIO3,下列说法正确的是
Cl2+2KIO3,下列说法正确的是
- A.KClO3和KIO3均属于离子化合物,只含有离子键
- B.反应过程中I2置换出Cl2,由此可推断非金属性I>Cl
- C.为防止反应的尾气造成大气污染,可以用饱和食盐水吸收尾气
- D.制备KIO3的反应中I2被氧化
D
分析:A.非金属元素之间为共价键;
B.反应中I元素的化合价升高,Cl元素的化合价降低,还原性I2>Cl2;
C.氯气有毒,应利用NaOH溶液吸收尾气;
D.I元素的化合价升高,碘作还原剂被氧化.
解答:A.非金属元素之间为共价键,则KClO3和KIO3均属于离子化合物,含有离子键、共价键,故A错误;
B.反应中I元素的化合价升高,Cl元素的化合价降低,还原性I2>Cl2,则非金属性Cl>I,故B错误;
C.氯气有毒,应利用NaOH溶液吸收尾气,饱和食盐水抑制氯气的溶解,故C错误;
D.I元素的化合价升高,碘作还原剂,在反应中被氧化,故D正确;
故选D.
点评:本题考查氧化还原反应,涉及化学键、非金属性的比较、尾气处理及氧化还原反应,注意判断反应中元素的化合价变化及有关概念来解答,题目难度中等.
分析:A.非金属元素之间为共价键;
B.反应中I元素的化合价升高,Cl元素的化合价降低,还原性I2>Cl2;
C.氯气有毒,应利用NaOH溶液吸收尾气;
D.I元素的化合价升高,碘作还原剂被氧化.
解答:A.非金属元素之间为共价键,则KClO3和KIO3均属于离子化合物,含有离子键、共价键,故A错误;
B.反应中I元素的化合价升高,Cl元素的化合价降低,还原性I2>Cl2,则非金属性Cl>I,故B错误;
C.氯气有毒,应利用NaOH溶液吸收尾气,饱和食盐水抑制氯气的溶解,故C错误;
D.I元素的化合价升高,碘作还原剂,在反应中被氧化,故D正确;
故选D.
点评:本题考查氧化还原反应,涉及化学键、非金属性的比较、尾气处理及氧化还原反应,注意判断反应中元素的化合价变化及有关概念来解答,题目难度中等.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案
相关题目
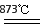
 Cl2
+2KIO3,下列说法正确的是
Cl2
+2KIO3,下列说法正确的是