题目内容
(11分)某研究性学习小组为探究铜、锌与浓盐酸的反应,设计实验探究方案如下:
实验用品:纯锌片、铜片、37%的浓盐酸、蒸馏水、氯化钾溶液、稀硝酸溶液
实验记录:
背影资料:
|
|
请你参与以下探究:
(1)实验A反应速度明显比B小,原因是 。
(2)根据“铜位于金属活动顺序表氢之后,与稀盐酸不反应,而在实验中加热时又产生气体”的事实,作出如下推断:
①有同学认为“实验C中加热时产生的气体是溶解在溶液中的H2”,你认为是否有道理,理由是 。
②某同学作了如下猜想:是否成立?请你设计实验方案加入验证。
| 猜想 | 验证方法 | 预测现象及结论 |
| 认为铜片中可能含有锌等杂质 | | |
| 猜想 | 预计验证方法 | 猜想的现象与结论 |
| 白色沉淀是氯化亚铜 | | |
| | |
.(11分)
(1)铜锌及浓盐酸一起组成了原电池,加快了反应速率 …………2分
(2)①没道理,因为H2本身难溶于水 …………1分
②(2分)将铜片加入稀硫酸中,并微热 若无气体放出,则不含锌等活泼金属杂质;若有气体则有锌等杂质
(3)(4分)
(4)[CuCl4]3-(aq) CuCl(s)+3Cl-(aq)白色沉淀是氯化亚铜 向白色沉淀中加入稀HNO3等强氧化剂 溶液变蓝色,说明是一价铜 向氯化亚铜悬浊液中加入氯化钾溶液 如白色沉淀消失且得无色溶液,则原溶液为氯化亚铜,否则不是
解析

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
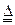 2Cu2O+O2↑
2Cu2O+O2↑