题目内容
【题目】(1)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,用单线桥法标明电子转移的方向和数目__________________________________________;氧化剂与还原剂的物质的量之比是___________,当有71gCl2生成时,被氧化的HCl的物质的量是________mol。
MnCl2+Cl2↑+2H2O,用单线桥法标明电子转移的方向和数目__________________________________________;氧化剂与还原剂的物质的量之比是___________,当有71gCl2生成时,被氧化的HCl的物质的量是________mol。
(2)向20mL某物质的量浓度的AlCl3溶液中逐滴加入2mol/L NaOH溶液,得到Al(OH)3沉淀最大质量为0.78g,当溶液中有Al(OH)3沉淀0.39g,则用去NaOH溶液的体积可能为_________。
【答案】 略 略 略 7.5ml 17.5ml
【解析】(1)在该反应中,Mn元素从+4价降低为+2价,MnO2作氧化剂,Cl元素从-1价升高到0价,HCl作还原剂,同时另一部分HCl起酸性作用生成MnCl2。用单线桥表示电子转移的方向和数目为: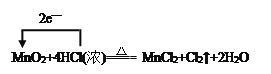 根据电子转移守恒可知,4molHCl中作还原剂2molHCl,起酸性作用的为2mol HCl,所以氧化剂与还原剂的物质的量之比是1∶2,当有71gCl2生成时,则有2mol HCl被氧化。
根据电子转移守恒可知,4molHCl中作还原剂2molHCl,起酸性作用的为2mol HCl,所以氧化剂与还原剂的物质的量之比是1∶2,当有71gCl2生成时,则有2mol HCl被氧化。
(2)已知Al(OH)3沉淀最大质量为0.78g,则n(Al(OH)3)=0.01mol,所以n(AlCl3)=0.01mol,而生成0.39g 即0.005molAl(OH)3沉淀,有两种情况:第一,加入的NaOH少,只生成0.005mol Al(OH)3沉淀,则由反应Al3++3OH-=Al(OH)3↓求得需要n(NaOH)=0.015mol,则V(NaOH)=即7.5mL;第二,加入的NaOH使Al3+全部沉淀后又溶解一部分,剩余0.005mol Al(OH)3沉淀,则由反应Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+2H2O,求得n(NaOH)= 0.01mol ×3+0.005mol×1=0.035 mol,所以V(NaOH)=,即17.5 mL。

 ABC考王全优卷系列答案
ABC考王全优卷系列答案【题目】硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S↓ + H2O下列各组实验中最先出现浑浊的是
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(mol·L-1) | V/mL | c/(mol·) | V/mL | ||
A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
A. A B. B C. C D. D
【题目】
(1)下列关于实验的叙述中正确的有 (填字母)。
A.不慎碰翻燃着的酒精灯使酒精在桌面上燃烧起来,应立即用湿抹布灭火 |
B.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗 |
C.先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称 |
D.把试剂瓶中的Na2CO3溶液倒入试管中,发现取量过多,为了不浪费,又把多余的试剂倒入原试剂瓶中 |
E.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
F.使用分液漏斗前要检查其是否漏水
G.用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液中的水全部加热蒸干
(2)某学校实验室从化学试剂商店买回18.4 mol·L-1的硫酸。
现将该浓硫酸配制成100 mL 1 mol·L-1的稀硫酸。可供选用的仪器有:
a.胶头滴管 b.烧瓶 c.烧杯 d.药匙 e.量筒 f.托盘天平
请回答下列问题:
① 配制稀硫酸时,上述仪器中不需要使用的有 (选填序号),还缺少的仪器有 (写仪器名称)。
② 配制100 mL 1 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为 mL(保留一位小数),量取浓硫酸时应选用 (填序号)规格的量筒。
a.10 mL b.50 mL c.100 mL

