题目内容
【题目】下列离子方程式的书写正确的是( )
A.大理石与盐酸反应:CO32﹣+2H+=CO2↑+H2O
B.铜和硝酸银溶液反应:Cu+Ag+=Cu2++Ag
C.氯气溶于水:Cl2+H2O═2H++Cl﹣+ClO﹣
D.硫酸与氢氧化钡溶液反应:2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O
【答案】D
【解析】
A、大理石成分是CaCO3,CaCO3难溶于水,不能拆写成离子,正确的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,故A错误;
B、反应前后电荷不守恒,正确的是Cu+2Ag+=Cu2++2Ag,故B错误;
C、HClO为弱酸,书写离子方程式时不能拆写成离子,正确的是Cl2+H2O![]() H++Cl-+HClO,故C错误;
H++Cl-+HClO,故C错误;
D、硫酸和Ba(OH)2发生2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D正确;
答案选D。

【题目】研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0
N2(g)+2CO2(g) ΔH<0
①一定条件下,将体积比为1∶2的NO、CO气体置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___(填字母)。
A.体系压强保持不变 B.混合气体颜色保持不变
C.N2和CO2的体积比保持不变 D.v正(CO)=2v逆(N2)
②20min时,若改变反应条件,导致N2浓度发生如下图所示的变化,则改变的条件可能是______(填字母)。
A.加入催化剂 B.降低温度 C.增加CO2的量 D.缩小容器体积

(2)在一定条件下,将SO2和NO2通入绝热恒容密闭容器中,发生反应:SO2(g)+NO2(g) ![]() SO3(g) +NO(g),正反应速率随时间变化如图所示。由图可得出的正确结论是__(填字母)
SO3(g) +NO(g),正反应速率随时间变化如图所示。由图可得出的正确结论是__(填字母)

A.反应在c点达到平衡状态
B.反应物浓度:b点小于c点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2时,SO2的转化率:a~b段小于b~c段
(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2可制备二甲醚(DME)。观察图回答问题。

催化剂中n(Mn)/n(Cu)约为__________时最有利于二甲醚的合成。
(4)工业上可以用CO和H2生产燃料甲醇:CO(g)+2H2(g)![]() CH3OH(g)ΔH=-92.9kJ/mol,300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
CH3OH(g)ΔH=-92.9kJ/mol,300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
平衡 时的 数据 | CH3OH浓度/mol·L-1 | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收c kJ | ||
体系压强/Pa | p1 | p2 | p3 | |
反应物转化率 | α1 | α2 | α3 | |
下列说法中正确的是____________
A.2c1>c3 B.a+b=92.9 C.2p2<p3 D.α1+α3<1
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
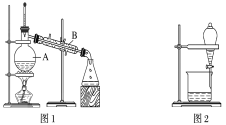
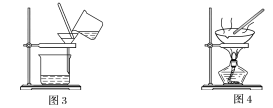
(1)装置图1中B的名称是________________,图2中漏斗的名称是________________。A中一般要加入碎瓷片,其作用是__________________________。下列关于以上实验操作说法一定正确的是_。
A.图1实验中,加热一段时间后发现未加入碎瓷片,应马上添加,以防发生危险
B.图2实验中,应打开活塞,将有机溶剂从下端导管中放出
C.图3实验中,可以用玻璃棒在漏斗中搅拌,以加快过滤速度
D.图4实验中,当加热至有较多固体析出时,即停止加热
(2)现有一瓶A和B的混合液,已知它们的性质如下表。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水和酒精 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离可选用上图中的图________________所示仪器。
(3)在图2所示实验中,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。____。
