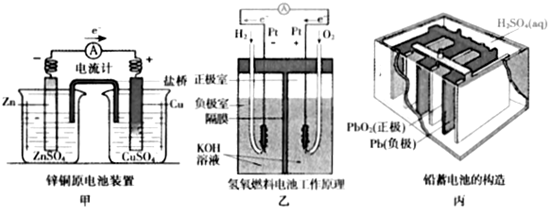
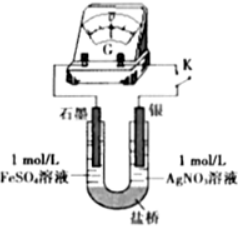
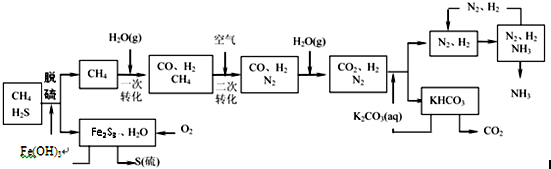
题目内容
13.在C2H2、C6H6、C2H4O组成的混合物中,已知氧元素的质量分数为16%,则混合物中碳元素的质量分数是( )| A. | 92.3% | B. | 87.6% | C. | 75.7% | D. | 84% |
分析 C2H4O可以表示为C2H2.H2O,故混合气体可以看做C6H6、C2H2、H2O的混合物,根据O元素的分数计算H2O的质量分数,进而计算C6H6、C2H2总的质量分数,C6H6、C2H2的最简式为CH,故C、H质量之比为12:1,据此计算C元素的质量分数.
解答 解:C2H4O可以表示为C2H2.H2O,故混合气体可以看做C6H6、C2H2、H2O的混合物,O元素的分数为16%,故H2O的质量分数为$\frac{\frac{16%}{16}}{18}$=18%,故C6H6、C2H2总的质量分数1-18%=82%,C6H6、C2H2的最简式为CH,故C、H质量之比为12:1,故C元素的质量分数为82%×$\frac{12}{12+1}$=75.7%,故选C.
点评 本题考查混合物中元素质量分数的计算,难度中等,关键是根据化学式将物质转化为最简式为CH与水的混合物.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
14.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,4.4 g二氧化碳中所含碳原子数为0.1 NA | |
| B. | 标准状况下,11.2 L H2O中所含氧原子数为0.5 NA | |
| C. | 100mL 1mol/L的氯化铝溶液中所含氯离子数为0.1 NA | |
| D. | 实验室用H2O2制O2,每产生标准状况下11.2 L O2,转移的电子数为2 NA |
18.在反应4NH3+5O2═4NO+6H2O中,下列说法正确的是( )
| A. | NH3在反应中被氧化 | B. | O2在反应中失去电子 | ||
| C. | NH3在反应中得到电子 | D. | 1mol氧化剂在反应中得到4mol电子 |
5.下列反应的能量变化属于吸热反应的是( )
| A. | 氢氧化钠溶液与盐酸反应 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 铝片与盐酸反应 | D. | 钠与冷水反应 |
2.日本福岛核电站的核原料铀-235(92235U)裂变释放出碘-131(53131I)和铯-137(55137Cs),关于它们的说法正确的是( )
| A. | 铀-235和碘-131是同位素 | B. | 碘-131的质子数为131 | ||
| C. | 铀-235的中子数是143 | D. | 碘-131和铯-137是同种元素 |
3.下列各组离子,能大量共存于同一溶液中的是( )
| A. | Na+、Cl-、Mg2+、SO42- | B. | H+、K+、NO3-、CO32-、 | ||
| C. | Ag+、NO3-、Cl -、Cu2+ | D. | Ba2+、Na+、NO3-、SO42- |