题目内容
有三组物质(l)NO2和溴蒸气,(2)乙醛、苯和 CCl4三种无色液体,(3)硫酸铜、碳酸钙、碘化钠和干燥的碱石灰(内含少量酚酞)四种白色粉末。只用一种试剂就能将三组物质中的各种物质一一鉴别出来,这种试剂可以是( )A.蒸馏水 B.Na2CO3溶液
C.汽油 D.NaOH溶液

目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4 (g)与NO2 (g)反应生成N2 (g) ,CO2(g)和H2O(l)的热化学方程 式_____________________
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)  N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下
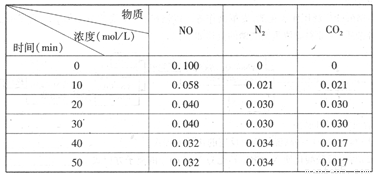
①不能作为判断反应达到化学平衡状态的依据 是_______
A.容器内CO2的浓度保持不变
B.v正(N2)=2 v正(NO)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
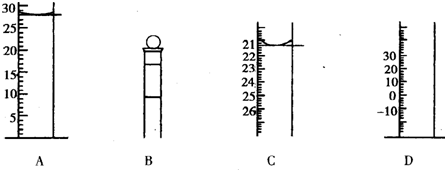
②在T。C时.该反应的平衡常数为_______(保留两位小数);
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是_______
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:
2CO+2NO  N2+2CO2 ΔH<0 研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。
N2+2CO2 ΔH<0 研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。

①上表中:a=_______,b=________,e=________
②请在给出的坐标图中,画出上表中实验II和实验III条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明相应的实验编号

(15分)(1)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+2CO  2CO2+N2
2CO2+N2
研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中:
|
实验编号 |
T/℃ |
NO初始浓度 mol·L-1 |
CO初始浓度 mol·L-1 |
催化剂的比表面积 ㎡·g-1 |
|
Ⅰ |
280 |
1.2×10-3 |
5.8×10-3 |
82 |
|
Ⅱ |
|
|
|
124 |
|
Ⅲ |
350 |
|
|
124 |
①请在表格中填入剩余的实验条件数据。
②设计实验Ⅱ、Ⅲ的目的是 。
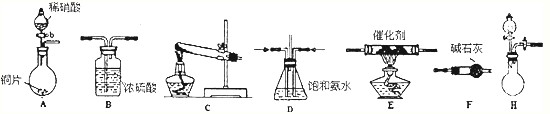
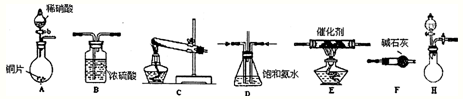
(2)工业尾气中氮的氧化物常采用氨催化吸收法,原理是NH3与NOx反应生成无毒的物质。某同学采用以下装置和步骤模拟工业上氮的氧化物处理过程。提供的装置:
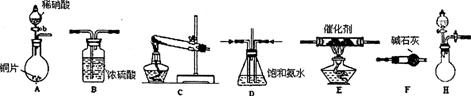
步骤一、NH3的制取
①所提供的装置中能快速、简便制取NH3的装置是: (填装置序号)。
②若采用C装置制取氨气(控制实验条件相同),情况如下表:
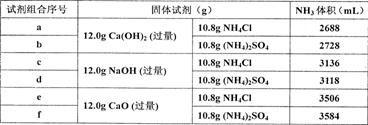
分析表中数据,实验室制NH3产率最高的是 (填序号),其它组合NH3产率不高的原因是 。
步骤二、模拟尾气的处理选用上述部分装置,按下列顺序连接成模拟尾气处理装置:
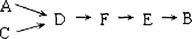
①A中反应的离子方程式: 。
②D装置作用有:使气体混合均匀、调节气流速度,还有一个作用是: 。
③D装置中的液体可换成 (填序号)。zxxk
a.CuSO4溶液 b.H2O c.CCl4 d.浓H2SO4
④该同学所设计的模拟尾气处理实验还存在的明显缺陷是: 。
 2CO2+N2
2CO2+N2