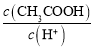题目内容
【题目】830 K时,在密闭容器中发生下列可逆反应: CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0 。请回答下列问题:
CO2(g)+H2(g) ΔH<0 。请回答下列问题:
(1)若起始时c(CO) =2 mol·L-1,c(H2O) =3 mol·L-1,4 s后达到平衡,此时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____;用H2O表示的化学反应速率为_____。
(2)在相同温度下,若起始时c(CO) =1 mol·L-1,c(H2O) =2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,此时v(正)______ v(逆) (填“大于”“小于”或“等于”)。
(3)若降低温度,该反应的K值可能为______。
a.1 b.2 c.0.5
【答案】1 0.3 mol·L-1·s-1 大于 b
【解析】
CO的转化率为60%,则转化了1.2mol/L,
(1) CO(g) + H2O(g) ![]() CO2(g) + H2(g)
CO2(g) + H2(g)
始(mol/L) 2 3 0 0
转(mol/L) 1.2 1.2 1.2 1.2
平(mol/L) 0.8 1.8 1.2 1.2
K=![]() =
=![]() =1
=1
v(H2O)=![]() =
=![]() =0.3 mol·L-1·s-1;
=0.3 mol·L-1·s-1;
(2) CO(g) + H2O(g) ![]() CO2(g) + H2(g)
CO2(g) + H2(g)
始(mol/L) 1 2 0 0
转(mol/L) 0.5 0.5 0.5 0.5
一段时间(mol/L) 0.5 1.5 0.5 0.5
Qc=![]() =
=![]() =
=![]() <1,平衡正向移动,因此v(正>v(逆);
<1,平衡正向移动,因此v(正>v(逆);
(3)该反应为放热反应,降低温度,平衡常数K增大,有可能是2。
Q<K | 反应向正反应方向进行,v正>v逆 |
Q=K | 反应处于化学平衡状态,v正=v逆 |
Q>K | 反应向逆反应方向进行,v正<v逆 |

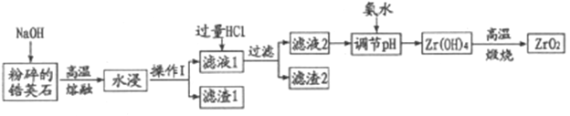
【题目】氧化材料具有高硬度、高强度、高韧性、极高的耐磨性及耐化学腐蚀性等优良的物化性能。以锆英石(主要成分为 ZrSiO4,含有少量Al2O3、SiO2、Fe2O3等杂质)为原料通过碱熔法制备氧化锆(ZrO2)的流程如下:
25℃时,有关离子在水溶液中沉淀时的pH数据:
Fe(OH)3 | Zr(OH)4 | Al(OH)3 | |
开始沉淀时pH | 1.9 | 2.2 | 3.4 |
沉淀完全时pH | 3.2 | 3.2 | 4.7 |
请回答下列问题:
(1)流程中旨在提高化学反应速率的措施有___________。
(2)操作I的名称是___________滤渣2的成分为___________。
(3)锆英石经“高温熔融”转化为Na2ZrO3,写出该反应的化学方程式:___________。
(4)“调节pH”时,合适的pH范围是___________。为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是___________。
(5)写出“高温煅烧”过程的化学方程式___________。根据ZrO2的性质,推测其两种用途___________。