题目内容
用稀硫酸、盐酸、醋酸、碳酸氢钠、碳酸钾、碳酸钡、硫酸氢钠几种物质在溶液中反应,符合离子反应:2H+ + CO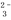 = H2O + CO2↑的化学方程式的个数是
= H2O + CO2↑的化学方程式的个数是
A.2 B.3 C.6 D.9
练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
题目内容
用稀硫酸、盐酸、醋酸、碳酸氢钠、碳酸钾、碳酸钡、硫酸氢钠几种物质在溶液中反应,符合离子反应:2H+ + CO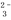 = H2O + CO2↑的化学方程式的个数是
= H2O + CO2↑的化学方程式的个数是
A.2 B.3 C.6 D.9
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案