题目内容
下表为长式周期表的一部分,其中的序号代表对应的元素。
(1)上表中元素⑨对应的二价阳离子未成对电子数目为______________。
(2)由元素③形成的一种不导电单质晶体,其名称为__________,该单质晶体类型为_________________,
在该晶体中,元素③的原子个数与形成的共价键键数之比为 。
(3)元素⑦与①⑤形成的化合物的化学键类型有_________ __________;根据对角线规则,元素②与⑧形成的物质为___________(填“离子化合物”或“共价化合物”)。
(4)元素④与元素①形成的X分子的空间构型为__________,用氢键表示式写出X分子间存在的氢键
_________________________。
(5)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是__________________________________________________。
(6)④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为__________________________________________。
(7)元素⑩的蓝色硫酸盐溶液显______性,用离子方程式表示其原因____________。
| ① | | | | | | | | | | | | | | | | | |
| | ② | | | | | | | | | | | | ③ | ④ | ⑤ | ⑥ | |
| | ⑦ | | | | | | | | | | | | | | | ⑧ | |
| | | | | | | | ⑨ | | | ⑩ | | | | | | | |
(2)由元素③形成的一种不导电单质晶体,其名称为__________,该单质晶体类型为_________________,
在该晶体中,元素③的原子个数与形成的共价键键数之比为 。
(3)元素⑦与①⑤形成的化合物的化学键类型有_________ __________;根据对角线规则,元素②与⑧形成的物质为___________(填“离子化合物”或“共价化合物”)。
(4)元素④与元素①形成的X分子的空间构型为__________,用氢键表示式写出X分子间存在的氢键
_________________________。
(5)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是__________________________________________________。
(6)④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为__________________________________________。
(7)元素⑩的蓝色硫酸盐溶液显______性,用离子方程式表示其原因____________。
(1)4 (1分)
(2)金刚石 原子晶体 1:2(各1分)
(3) 离子键、共价键(2分,漏选得1分,有错选不得分) 共价化合物(1分)
(4)三角锥形(1分) N—H…N (1分)
(5)HF分子间通过氢键会形成(HF)n分子(或HF分子间会形成氢键)(1分)
(6)4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O (2分)
(7) 酸(1分) Cu2++2H2O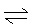 Cu(OH)2+ 2H+ (2分)
Cu(OH)2+ 2H+ (2分)
(2)金刚石 原子晶体 1:2(各1分)
(3) 离子键、共价键(2分,漏选得1分,有错选不得分) 共价化合物(1分)
(4)三角锥形(1分) N—H…N (1分)
(5)HF分子间通过氢键会形成(HF)n分子(或HF分子间会形成氢键)(1分)
(6)4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O (2分)
(7) 酸(1分) Cu2++2H2O
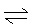 Cu(OH)2+ 2H+ (2分)
Cu(OH)2+ 2H+ (2分)试题分析:根据元素周期表结构,可以确定①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩元素分别为:H、Be、C、N、O、F、Mg、Cl、Cr、Cu;(1)⑨是Cr元素,Cr是24号元素,其原子核外有24个电子,根据能量最低原理及洪特规则书写其核外电子排布式,3d能级的能量大于4s能级的能量,所以先排4s后排3d,轨道中的电子处于全满、半满、全空时原子最稳定,所以Cr的核外电子排布式为1s22s22p63s23p63d54s1,其对应的二价阳离子的核外电子排布式为1s22s22p63s23p63d4,,所以二价阳离子未成对电子数目为4;(2)由元素③形成的一种不导电单质晶体,其名称为金刚石,其为原子晶体;金刚石为正四面体结构,一个碳连接着四个碳原子,所以原子个数与形成的共价键键数之比为1:2;(3)元素⑦与①⑤形成的化合物为氯化铵,其含有的化学键的类型有:离子键、共价键;根据对角线规则,元素②与⑧形成的物质为氯化铍,其属于共价化合物;(4)元素④与元素①形成X分子,其为氨气,其空间构型为三角锥形,用氢键表示式写出X分子间存在的氢键为:N—H…N;(5)元素①与⑥形成化合物为HF,由于其分子间形成了氢键,所以测定器相对分子质量时,其实验测得的值一般高于理论值;(7)元素⑩的蓝色硫酸盐为硫酸铜,其为强酸弱碱盐,其溶液显示酸性,原因是铜离子的水解用离子方程式表示其原因为:Cu2++2H2O
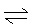 Cu(OH)2+ 2H+。
Cu(OH)2+ 2H+。点评:本题考查了元素周期表、元素周期律、元素及其化合物、盐类水解等知识,该这些考点都是高考考查的热点,本题难度中等。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 Si3N4+12H2
Si3N4+12H2 4NH3↑+SiH4↑+2MgCl2(△H < 0)
4NH3↑+SiH4↑+2MgCl2(△H < 0)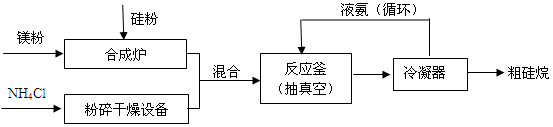
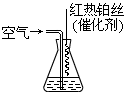
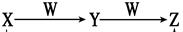
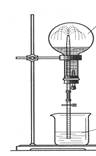

 2 NaOH+ H2↑
2 NaOH+ H2↑