题目内容
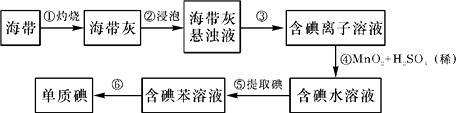
【题目】锌锰干电池为使用一次后就被废弃的电池,因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
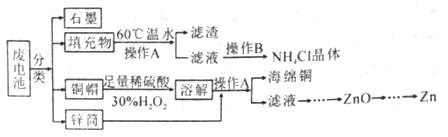
(1)用60℃温水溶解填充物,目的是________。
(2)操作B的名称为_____________。
(3)铜帽溶解的化学方程式为__________;铜帽溶解完全后,可采用_____方法除去溶液中过量的H2O2。
(4)填充物中含有MnOOH、MnO2等化合物,向滤渣中加入一定量的稀草酸和l0mL稀硫酸,得到MnSO4溶液并收集到896mLCO2(标准状况下),所用稀硫酸的物质的量浓度是_________。
(5)向一定量水样中加入适量MnSO4溶液和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,运用此方法可以测定水中溶解氧的浓度。测定过程中物质的转化关系如下:
![]()
取一定量的池塘水样l00.00mL,按上述方法测定水样的溶解氧,消耗0.0100molL-1 Na2S2O3标准溶液13.50mL,该水样中的溶解氧的浓度为____mgL-1。
【答案】 加大溶解速率,同时防止温度过高氯化铵分解 结晶 Cu+H2O2+H2SO4=CuSO4+2H2O 加热 3.0mol/L 10.80mg/L
【解析】废旧干电池含有铜、石墨、二氧化锰以及填充物等,填充物用60℃充分溶解,过滤,滤液中含有氯化铵,蒸发、浓缩、结晶可得到氯化铵晶体;铜与稀硫酸在过氧化氢作用发生氧化还原反应生成硫酸铜,加入锌可置换出铜,过滤分离,硫酸锌溶液最终可生成氢氧化锌、氧化锌,冶炼可得到锌。(1)加热,适当升高温度,可促进溶解,故答案为:加大溶解速率,同时防止温度过高氯化铵分解;(2)滤液中含有氯化铵,蒸发、浓缩、结晶可得到氯化铵晶体,所以该操作名称是结晶;(2)酸性条件下,双氧水能将铜氧化,铜帽溶解反应生成铜离子,反应的化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O;加热条件下,双氧水易分解生成水和氧气,所以除去双氧水的方法是加热;(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。其主要反应为2 MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O,根据反应方程式可知,硫酸的物质的量为:![]() ×
×![]() =0.03mol,c=
=0.03mol,c=![]() =
=![]() =3.0mol/L;(5)根据转化关系:O2-MnO(OH)2-I2-Na2S4O6;在100.00mL水样中,存在I2+2S2O32-=2I-+S4O62-;n(I2)=
=3.0mol/L;(5)根据转化关系:O2-MnO(OH)2-I2-Na2S4O6;在100.00mL水样中,存在I2+2S2O32-=2I-+S4O62-;n(I2)=![]() =
=![]() =6.750×10-5mol,根据题中MnO(OH)2与I-完全反应生成Mn2+和I2,可知发生了氧化还原反应,根据电子得失守恒:n[MnO(OH)2]=n(I2)= 6.750×10-5mol;n(O2)=
=6.750×10-5mol,根据题中MnO(OH)2与I-完全反应生成Mn2+和I2,可知发生了氧化还原反应,根据电子得失守恒:n[MnO(OH)2]=n(I2)= 6.750×10-5mol;n(O2)=![]() n[MnO(OH)2]=
n[MnO(OH)2]=![]() ×6.750×10-5mol=3.375×10-5mol,水中溶解氧=
×6.750×10-5mol=3.375×10-5mol,水中溶解氧=![]() =10.80mg/L。
=10.80mg/L。