题目内容
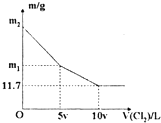 向1OO ml NaBr和NaI的混合溶液中缓慢通入适量的Cl2,充分反应后将所得溶液蒸干,并将所得同体灼烧至恒重,得到m g固体.m与通入Cl2的体积
向1OO ml NaBr和NaI的混合溶液中缓慢通入适量的Cl2,充分反应后将所得溶液蒸干,并将所得同体灼烧至恒重,得到m g固体.m与通入Cl2的体积(V(Cl2),标准状况〕关系如下图所示.则下列说法不正确的是( )
| A、v=0.224 | B、混合溶液中:c(Na+)=2mol/L | C、m2=25.3 | D、m1=18.55 |
分析:含NaBr和NaI的溶液中,通入Cl2,先发生Cl2+2NaI═2NaCl+I2,后发生Cl2+2NaBr═2NaCl+Br2,当氯气过量时,氯气把碘和溴全部置换出来,最后得到的固体为氯化钠,结合图象来计算.
解答:解:含NaBr和NaI的溶液中,通入Cl2,先发生Cl2+2NaI═2NaCl+I2,后发生Cl2+2NaBr═2NaCl+Br2,当氯气过量时,氯气把碘和溴全部置换出来,最后得到的固体为氯化钠,由图象可知11.7g固体为NaCl,n(NaCl)=
=0.2mol,则V(Cl2)=0.1mol×22.4L/mol=2.24L,
A.10V=2.24L,则V=0.224,故A正确;
B.n(NaCl)=
=0.2mol,则混合溶液中:c(Na+)=
=2mol/L,故B正确;
C.通入氯气5v时,n(Cl2)=0.05ml,发生Cl2+2NaI═2NaCl+I2,则n(NaI)=0.1mol,m(NaI)=0.1mol×150g/mol=15g,通入氯气10v时,发生Cl2+2NaBr═2NaCl+Br2,消耗氯气5v升,n(Cl2)=0.05ml,m(NaBr)=0.1mol×103g/mol=10.3g,则m2=25.3g,故C正确;
D.m1为m(NaBr)和m(NaCl),质量为10.3g+0.1mol×58.5g/mol=16.52g,故D错误.
故选D.
| 11.7g |
| 58.5g/mol |
A.10V=2.24L,则V=0.224,故A正确;
B.n(NaCl)=
| 11.7g |
| 58.5g/mol |
| 0.2mol |
| 0.1L |
C.通入氯气5v时,n(Cl2)=0.05ml,发生Cl2+2NaI═2NaCl+I2,则n(NaI)=0.1mol,m(NaI)=0.1mol×150g/mol=15g,通入氯气10v时,发生Cl2+2NaBr═2NaCl+Br2,消耗氯气5v升,n(Cl2)=0.05ml,m(NaBr)=0.1mol×103g/mol=10.3g,则m2=25.3g,故C正确;
D.m1为m(NaBr)和m(NaCl),质量为10.3g+0.1mol×58.5g/mol=16.52g,故D错误.
故选D.
点评:本题考查氯溴碘性质,侧重于学生的计算能力,注意把握氯气与溴化钠、碘化钠反应的先后顺序,难度中等,根据方程式计算该题.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目