题目内容
14.W、X、Y、Z是原子序数依次增大的同一周期主族元素,W是金属元素,X是地壳中含量最多的金属元素,且w、x的最高价氧化物的水化物相互反应生成盐和水;Y、Z是非金属元素,Y与W可形成离子化合物W2Y;G在Y的前一周期,其原子最外层比Y原子最外层少一个电子.(1)X的原子结构示意图为
 .
.(2)W、X的最高价氧化物的水化物相互反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
(3)G的气态氢化物与Z的气态氢化物反应生成的物质所属的晶体类型是离子晶体,其中所含化学键的类型有离子键、共价键、配位键.
(4)在催化剂作用下,汽车尾气中G的氧化物GO与一氧化碳两种气体能相互反应转化为无污染、能参与大气循环的两种气体,写出有关反应的化学方程式2NO+2CO═N2+2CO2;若有33.6L(已换算成标准状况)一氧化碳参加反应,转移的电子数为3NA.
(5)X单质可以与NaNO3、NaOH混合溶液反应,产物中单质只有G的单质,写出反应的离子方程式10Al+6NO3-+4OH-═10AlO2-+3N2↑+2H2O.
分析 W、X、Y、Z是原子序数依次增大的同一周期主族元素,X是地壳中含量最多的金属元素,则X为Al;W是金属元素,且W、X的最高价氧化物的水化物相互反应生成盐和水,可推知W为Na;Y、Z是非金属元素,Y与W可形成离子化合物W2Y,Y为-2价,可推知Y为S,结合原子序数可知Z为Cl;G在Y的前一周期,其原子最外层比Y原子最外层少一个电子,G原子最外层电子数=6-1=5,可推知G为N,据此解答.
解答 解:W、X、Y、Z是原子序数依次增大的同一周期主族元素,X是地壳中含量最多的金属元素,则X为Al;W是金属元素,且W、X的最高价氧化物的水化物相互反应生成盐和水,可推知W为Na;Y、Z是非金属元素,Y与W可形成离子化合物W2Y,Y为-2价,可推知Y为S,结合原子序数可知Z为Cl;G在Y的前一周期,其原子最外层比Y原子最外层少一个电子,G原子最外层电子数=6-1=5,可推知G为N.
(1)X为Al,原子核外有13的电子,其原子结构示意图为 ,
,
故答案为: ;
;
(2)W、X的最高价氧化物的水化物分别为NaOH、Al(OH)3,反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(3)G的气态氢化物与Z的气态氢化物反应生成的物质为NH4Cl,属于离子晶体,含有离子键、共价键、配位键,
故答案为:离子晶体;离子键、共价键、配位键;
(4)在催化剂作用下,汽车尾气中G的氧化物NO与一氧化碳两种气体能相互反应转化为无污染、能参与大气循环的两种气体,应生成氮气与二氧化碳,反应的化学方程式为:2NO+2CO═N2+2CO2;若有33.6L(已换算成标准状况)一氧化碳参加反应,CO物质的量为$\frac{33.6L}{22.4L/mol}$=1.5mol,C元素化合价由+2升高为+4,转移的电子数为1.5mol×2×NAmol-1=3NA,
故答案为:2NO+2CO═N2+2CO2;3NA;
(5)Al单质可以与NaNO3、NaOH混合溶液反应,产物中单质只有氮气,还生成偏铝酸钠与水,反应的离子方程式为:10Al+6NO3-+4OH-═10AlO2-+3N2↑+2H2O,
故答案为:10Al+6NO3-+4OH-═10AlO2-+3N2↑+2H2O.
点评 本题考查结构性质位置关系应用,涉及常用化学用语、元素化合物知识、氧化还原反应计算等,难度中等,推断元素是解题关键,(5)中离子方程式书写为易错点.

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案| 选项 | 叙述I | 叙述II |
| A. | KNO3的溶解度大 | 用重结晶法除去KNO3中混有的NaCl |
| B. | BaSO4难溶于酸 | 用盐酸和BaCl2溶液检验SO42- |
| C. | NH3能使酚酞溶液变红 | NH3可用于设计喷泉实验 |
| D. | Ca(OH)2能制成澄清石灰水 | 可配制2.0 mol?L-1的Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
 请运用化学反应原理的相关知识研究碳及其化合物的性质.
请运用化学反应原理的相关知识研究碳及其化合物的性质.(1)在一定体积的密闭容器中,进行如下化学反应,CO2(g)+H2(g)?CO(g)+H2O(g),平衡常数K与温度t℃的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
②该反应为吸热反应(填“吸热”或“放热”).
③某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(2)工业上一般以CO和H2为原料合成甲醇,一定温度下在恒容容器中,该反应的热化学方程式为:
CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
①下列措施中能说明反应达到平衡状态的是AD.
A.体系压强保持不变
B.混合气体的密度保持不变
C.CO与H2的浓度之比为1:2
D.单位时间内,消耗2molH2的同时消耗1molCH3OH
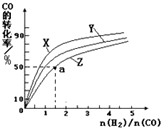
②在恒容容器中合成甲醇,当温度分别为230℃、250℃和270℃时,CO的转化率与n(H2):n(CO)的起始组成比的关系如图所示.已知容器体积1L,起始时CO的物质的量均为1mol.据此判断在上述三种温度中,曲线Z对应的温度是270℃;利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K等于4(mol/L)-2.
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 | Cl- CO32- NO3- SO42- I- |
Ⅰ.取该无色溶液5mL,滴加一滴氨水有沉淀生成,且离子种类增加.
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰.
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色.
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.下列推断不正确的是( )
| A. | 由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是K+、NH4+、Cu2+ | |
| B. | Ⅲ中加入盐酸生成无色气体的离子方程式是6I-+2NO3-+8H+═3I2+2NO↑+4H2O | |
| C. | 原溶液一定只含有的离子I-、NO3-、SO42-、Mg2+、Al3+ | |
| D. | 另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为0.4g |
| A. | 纯碱--盐 | B. | 干冰--混合物 | ||
| C. | 澄清石灰水--纯净物 | D. | 洁净的空气--纯净物 |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | Ⅵ | VⅡA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)②③⑦三种元素的原子半径从大到小的顺序为Cl>N>O(填元素符号)
(3)在最高价氧化物的水化物中,酸性最强的化合物的化学式HClO4,碱性最强的化合物的名称氢氧化钾.
(4)元素⑤的氧化物与元素④的最高价氧化物对应水化物反应的化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O.
(5)元素⑥和⑦形成的气态氢化物较稳定是HCl(填化学式),用方程式来说明元素⑦的非金属性比⑥的非金属强的事实Cl2+H2S=S↓+2HCl(一个或两个方程式均可)
(6)表示①与③形成的化合物的电子式
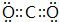 ,写出它的一种用途做灭火剂等.
,写出它的一种用途做灭火剂等.