题目内容
实验探究:乙醇的催化氧化实验.向试管中加入3~4mL无水乙醇,将铜丝烧热,迅速插入乙醇中,反复多次,观察铜丝的颜色先后发生的变化现象 ,综合整个过程,写出反应的总化学方程式 ,铜丝在反应中所起的作用是 .
分析:根据铜的性质及氧气的性质分析铜变黑的原因;再根据氧化铜的性质及乙醇的性质分析变黑的铜丝又恢复原来的红色原因进行解答.
解答:解:铜和空气中的氧气在加热条件下反应生成黑色的氧化铜,所以在酒精灯外焰灼烧铜丝观察到铜丝表面变黑,发生2Cu+O2
2CuO①反应;乙醇有还原性,氧化铜有氧化性,氧化铜和乙醇在加热条件下发生氧化还原反应生成铜和乙醛、水CuO+CH3CH2OH
CH3CHO+H2O+Cu②,Cu参加化学反应,只是经过一系列的化学反应后又生成了红色的Cu,所以铜是催化剂,将②×2+①得总反应为2CH3CH2OH+O2
2CH3CHO+2H2O,
故答案为:铜丝先变黑再变红;2CH3CH2OH+O2
2CH3CHO+2H2O;催化剂;
| ||
| △ |
| Cu |
| △ |
故答案为:铜丝先变黑再变红;2CH3CH2OH+O2
| Cu |
| △ |
点评:本题考查了乙醇乙醇的催化氧化,铜作催化剂,抓住“催化剂参加化学反应,只是经过一系列的化学反应后又生成了原来的物质”是解答的关键,题目难度不大.

练习册系列答案
相关题目

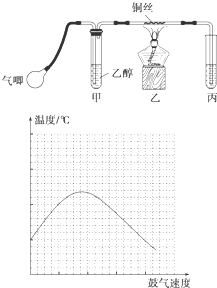 某研究性学习小组的同学利用如图所示装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去.实验时,先加热玻璃管中的铜丝,约1min后鼓入空气.
某研究性学习小组的同学利用如图所示装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去.实验时,先加热玻璃管中的铜丝,约1min后鼓入空气.
