题目内容
A、B、C、D、E、F为原子序数依次增大的短周期主族元素,已知A、C、F三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层少4个;E元素原子次外层电子数比最外层多3个。
(1)写出下列元素的符号:A , E 。
(2)A、C两种元素的最高价氧化物的水化物反应的离子方程式是 。
(3)A元素的最高价氧化物的水化物与C元素的最高价氧化物反应的化学方程式是 。
(4)与F元素处于同一主族的第四周期元素的基态原子核外电子排布式为 。
(5)用电子式表示B和F形成化合物的过程________________
(1)写出下列元素的符号:A , E 。
(2)A、C两种元素的最高价氧化物的水化物反应的离子方程式是 。
(3)A元素的最高价氧化物的水化物与C元素的最高价氧化物反应的化学方程式是 。
(4)与F元素处于同一主族的第四周期元素的基态原子核外电子排布式为 。
(5)用电子式表示B和F形成化合物的过程________________
(1)Na P (2)Al(OH)3+OH-=AlO2-+2H2O(3)Al2O3+2NaOH= 2NaAlO2+2H2O
(4) [Ar]3d104s24p5
(5)2Mg2++
 Mg2+
Mg2+ Mg2+
Mg2+
(4) [Ar]3d104s24p5
(5)2Mg2++

 Mg2+
Mg2+ Mg2+
Mg2+试题分析:A、C、F三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,则是酸碱的中和反应,那么C只能是具备两性的Al(OH)3,A为Na;D元素原子的最外层电子数比次外层少4个,所以D为Si;E元素原子次外层电子数比最外层多3个,则E为P,故F只能为Cl。
点评:元素周期表及其规律是高考必考知识点,考生在备考中应注意积累掌握短周期元素的结构与性质。

练习册系列答案
相关题目


 -1
-1 含中子N个,X的质量数为A,则a gX的氢化物中含质子的物质的量是( )
含中子N个,X的质量数为A,则a gX的氢化物中含质子的物质的量是( )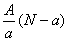 mol
mol mol
mol  mol
mol mol
mol