题目内容
(1)发射卫星用N2H4为燃料,NO2为氧化剂,两者反应生成N2和水蒸气, 已知
N2(g)+2O2(g)=2NO2(g) H1 =+ 67.7kJ/mol
N2H4(g)+O2(g)= N2(g)+2H2O(g) H2=- 534kJ/mol
试写出N2H4与 NO2反应的热化学方程式 ____________
(2)由氢气和氧气反应生成1mol水蒸气放热241.8KJ,写出该反应的热化学方程式_______________________ __________ 。
若1g水蒸气转化成液态水时放热2.444KJ,则反应H2(g) + 1/2O2(g) == H2O(l)的
△H=______________ kJ?![]() 。
。
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH=1135.7 kJ?mol-1
N2H4(g)+2F2(g)=N2(g)+4HF(g) ΔH=1126kJ?mol-1

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
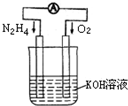 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.