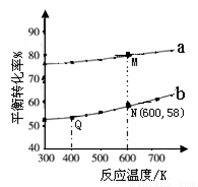
题目内容
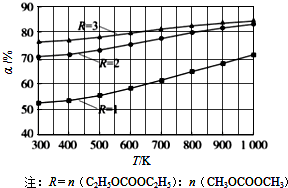
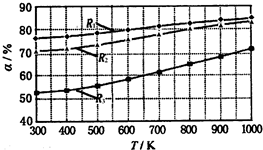 碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g)+CH3OCOOCH3(g)?2CH3OCOOC2H5(g).其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比( R=n(C2H3OCOOC2H5):n(CH3OCOOCH3 )的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法不正确的是.( )
碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g)+CH3OCOOCH3(g)?2CH3OCOOC2H5(g).其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比( R=n(C2H3OCOOC2H5):n(CH3OCOOCH3 )的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法不正确的是.( )| A、该反应△H>0 | B、R1对应的反应物配比为3:1 | C、650℃,反应物配比为1:1时,平衡常数K=6 | D、当C2H5OCOOC2H5与CH3OCOOC2H5生成速率比为1:2时,反应达到平衡状态 |
分析:A.配比一定时,根据CH3OCOOCH3转化率与温度关系,判断温度对平衡移动的影响;
B.增大一种反应物的浓度,可以通过其他反应物的转化率,C2H5OCOOC2H5的含量越高,CH3OCOOCH3(g)的转化率越大;
C.由图可知,R3表示反应物配比为1:1,650℃时CH3OCOOCH3(g)的转化率为60%,令反应物起始物质的量为1mol,用三段式计算平衡时各组分的物质的量,该反应前后气体的体积不变,利用物质的量代替浓度代入平衡常数表达式计算;
D.不同物质表示的正、逆速率之比等于化学计量数之比,可逆反应到达平衡.
B.增大一种反应物的浓度,可以通过其他反应物的转化率,C2H5OCOOC2H5的含量越高,CH3OCOOCH3(g)的转化率越大;
C.由图可知,R3表示反应物配比为1:1,650℃时CH3OCOOCH3(g)的转化率为60%,令反应物起始物质的量为1mol,用三段式计算平衡时各组分的物质的量,该反应前后气体的体积不变,利用物质的量代替浓度代入平衡常数表达式计算;
D.不同物质表示的正、逆速率之比等于化学计量数之比,可逆反应到达平衡.
解答:解:A.由图可知,配比一定时,温度越大,CH3OCOOCH3的平衡转化率越大,升高温度平衡向正反应移动,则该反应的正反应为吸热反应,所以△H>0,故A正确;
B.由图可知,温度一定时R1表示的CH3OCOOCH3的平衡转化率最大,C2H5OCOOC2H5的含量越高,CH3OCOOCH3(g)的转化率越大,故R1表示的反应物配比为3:1,故B正确;
C.由图可知,R3表示反应物配比为1:1,650℃时CH3OCOOCH3(g)的转化率为60%,令反应物起始物质的量为1mol,则;
C2H5OCOOC2H5(g)+CH3OCOOCH3(g)?2CH3OCOOC2H5(g)
开始(mol):1 1 0
变化(mol):0.6 0.6 1.2
平衡(mol):0.4 0.4 1.2
故该温度下平衡常数k=
=9,故C错误;
D.C2H5OCOOC2H5与CH3OCOOC2H5生成速率分别为逆反应、正反应速率,速率之比为1:2,等于化学计量数之比
比,反应达到平衡,故D正确;
故选C.
B.由图可知,温度一定时R1表示的CH3OCOOCH3的平衡转化率最大,C2H5OCOOC2H5的含量越高,CH3OCOOCH3(g)的转化率越大,故R1表示的反应物配比为3:1,故B正确;
C.由图可知,R3表示反应物配比为1:1,650℃时CH3OCOOCH3(g)的转化率为60%,令反应物起始物质的量为1mol,则;
C2H5OCOOC2H5(g)+CH3OCOOCH3(g)?2CH3OCOOC2H5(g)
开始(mol):1 1 0
变化(mol):0.6 0.6 1.2
平衡(mol):0.4 0.4 1.2
故该温度下平衡常数k=
| 1.22 |
| 0.4×0.4 |
D.C2H5OCOOC2H5与CH3OCOOC2H5生成速率分别为逆反应、正反应速率,速率之比为1:2,等于化学计量数之比
比,反应达到平衡,故D正确;
故选C.
点评:本题考查外界条件对平衡移动的影响,正确分析图象是解本题关键,化学平衡状态的判断及平衡常数的计算是学习的重点,应该重点掌握.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目
 (2012?广州一模)碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液,生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g)+CH3OCOOCH3(g)?2CH3OCOOC2H5(g)△H1
(2012?广州一模)碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液,生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g)+CH3OCOOCH3(g)?2CH3OCOOC2H5(g)△H1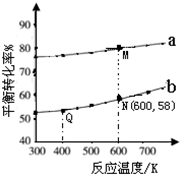 (2013?东城区二模)已知:
(2013?东城区二模)已知: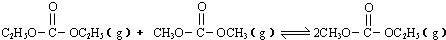 是碳酸甲乙酯的工业生产原理.如图是投料比[
是碳酸甲乙酯的工业生产原理.如图是投料比[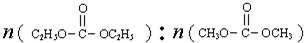 ]分别为3:1和1:1、反应物的总物质的量相同时,
]分别为3:1和1:1、反应物的总物质的量相同时, 的平衡转化率与温度的关系曲线.下列说法正确的是( )
的平衡转化率与温度的关系曲线.下列说法正确的是( ) 2
CH3OCOOC2H5(g).其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T),反应物配比(R=n(C2H5OCOOC2H5):n(CH3OCOOCH3))的关系如下图所示. 三种反应物配比分别为1:1,2:1,3:1.下列说法不正确的是( )
2
CH3OCOOC2H5(g).其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T),反应物配比(R=n(C2H5OCOOC2H5):n(CH3OCOOCH3))的关系如下图所示. 三种反应物配比分别为1:1,2:1,3:1.下列说法不正确的是( )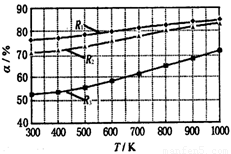
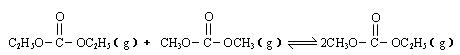 是碳酸甲乙酯的工业生产原理。下图是投料比[
是碳酸甲乙酯的工业生产原理。下图是投料比[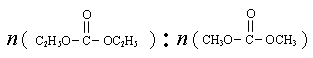 ]分别为3︰1和1︰1、反应物的总物质的量相同时,
]分别为3︰1和1︰1、反应物的总物质的量相同时,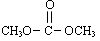 的平衡转化率与温度的关系曲线。下列说法正确的是
的平衡转化率与温度的关系曲线。下列说法正确的是