题目内容
(2014?滨州一模)(l)铝与某些金属氧化物在高温下的反应称为铝热反应,可用于冶炼高熔点金属.
已知:4Al(s)+3O2(g)═2Al2O3(s)△H=-2830kJ?mol-1
Fe2O3(s)+
C(s)═
CO2(g)+2Fe(s)△H=+230kJ?mol-1
C(s)+O2(g)═CO2(g)△H=-390kJ?mol-1
铝与氧化铁发生铝热反应的热化学方程式是
(2)如图1所示,各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是
装置②中Cu电极上的电极反应式为
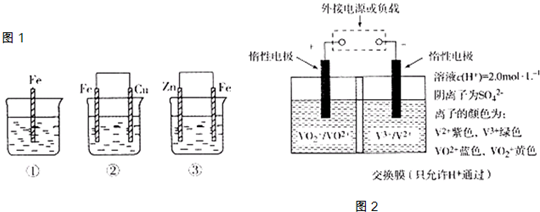
(3)钒(V)及其化合物广泛应用于新能源领域.全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图2所示.
①当左槽溶液逐渐由黄变蓝,其电极反应式为
②充电过程中,右槽溶液颜色逐渐由
已知:4Al(s)+3O2(g)═2Al2O3(s)△H=-2830kJ?mol-1
Fe2O3(s)+
| 3 |
| 2 |
| 3 |
| 2 |
C(s)+O2(g)═CO2(g)△H=-390kJ?mol-1
铝与氧化铁发生铝热反应的热化学方程式是
2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s)△H=-600kJ/mol
2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s)△H=-600kJ/mol
.(2)如图1所示,各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是
②>①>③
②>①>③
;装置②中Cu电极上的电极反应式为
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.
(3)钒(V)及其化合物广泛应用于新能源领域.全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图2所示.
①当左槽溶液逐渐由黄变蓝,其电极反应式为
VO2++2H++e-=VO2++H2O
VO2++2H++e-=VO2++H2O
.②充电过程中,右槽溶液颜色逐渐由
绿
绿
色变为紫
紫
色.分析:(1)①4Al(s)+3O2(g)═2Al2O3(s)△H=-2830kJ?mol-1,
②Fe2O3(s)+
C(s)=
CO2(g)+2Fe(s)△H=+230kJ?mol-1,
③C(s)+O2(g)═CO2(g)△H=-390kJ?mol-1,
由盖斯定律可知,①×
+②-③×
可得到2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s);
(2)①发生化学腐蚀,②中构成原电池,且Fe为负极,③构成原电池,但Fe为正极;装置②中Cu电极上氧气得电子,发生吸氧腐蚀的电极反应;
(3)①溶液逐渐由黄变蓝,则VO2+得电子生成VO2+;
②原电池中左边为正极,右边为负极,则充电时,右槽为阴极,发生还原反应,则V3+得到电子生成V2+.
②Fe2O3(s)+
| 3 |
| 2 |
| 3 |
| 2 |
③C(s)+O2(g)═CO2(g)△H=-390kJ?mol-1,
由盖斯定律可知,①×
| 1 |
| 2 |
| 3 |
| 2 |
(2)①发生化学腐蚀,②中构成原电池,且Fe为负极,③构成原电池,但Fe为正极;装置②中Cu电极上氧气得电子,发生吸氧腐蚀的电极反应;
(3)①溶液逐渐由黄变蓝,则VO2+得电子生成VO2+;
②原电池中左边为正极,右边为负极,则充电时,右槽为阴极,发生还原反应,则V3+得到电子生成V2+.
解答:解:(1)①4Al(s)+3O2(g)═2Al2O3(s)△H=-2830kJ?mol-1,
②Fe2O3(s)+
C(s)=
CO2(g)+2Fe(s)△H=+230kJ?mol-1,
③C(s)+O2(g)═CO2(g)△H=-390kJ?mol-1,
由盖斯定律可知,①×
+②-③×
可得到2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s),
则△H=(-2830kJ?mol-1)×
+(+230kJ?mol-1)-(-390kJ?mol-1)×
=-600kJ/mol,
故答案为:2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s)△H=-600kJ/mol;
(2)①发生化学腐蚀,②中构成原电池,且Fe为负极,③构成原电池,但Fe为正极,所以铁在其中被腐蚀时由快到慢的顺序是②>①>③;
装置②中Cu电极上氧气得电子,发生吸氧腐蚀的电极反应,电极反应为O2+2H2O+4e-=4OH-,
故答案为:②>①>③;O2+2H2O+4e-=4OH-;
(3)①溶液逐渐由黄变蓝,则VO2+得电子生成VO2+,电极反应为VO2++2H++e-=VO2++H2O,故答案为:VO2++2H++e-=VO2++H2O;
②原电池中左边为正极,右边为负极,则充电时,右槽为阴极,发生还原反应,则V3+得到电子生成V2+,观察到充电时右槽溶液颜色逐渐由绿色变为紫色,
故答案为:绿;紫.
②Fe2O3(s)+
| 3 |
| 2 |
| 3 |
| 2 |
③C(s)+O2(g)═CO2(g)△H=-390kJ?mol-1,
由盖斯定律可知,①×
| 1 |
| 2 |
| 3 |
| 2 |
则△H=(-2830kJ?mol-1)×
| 1 |
| 2 |
| 3 |
| 2 |
故答案为:2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s)△H=-600kJ/mol;
(2)①发生化学腐蚀,②中构成原电池,且Fe为负极,③构成原电池,但Fe为正极,所以铁在其中被腐蚀时由快到慢的顺序是②>①>③;
装置②中Cu电极上氧气得电子,发生吸氧腐蚀的电极反应,电极反应为O2+2H2O+4e-=4OH-,
故答案为:②>①>③;O2+2H2O+4e-=4OH-;
(3)①溶液逐渐由黄变蓝,则VO2+得电子生成VO2+,电极反应为VO2++2H++e-=VO2++H2O,故答案为:VO2++2H++e-=VO2++H2O;
②原电池中左边为正极,右边为负极,则充电时,右槽为阴极,发生还原反应,则V3+得到电子生成V2+,观察到充电时右槽溶液颜色逐渐由绿色变为紫色,
故答案为:绿;紫.
点评:本题为综合题,涉及盖斯定律计算反应热及书写热化学反应方程式、原电池、吸氧腐蚀、二次电池等,(3)为解答的难点,注意电解与原电池的关系及溶液中离子的颜色,题目难度较大.

练习册系列答案
相关题目