题目内容
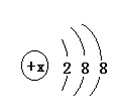
(1)有几种元素的微粒电子层结构如图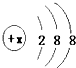 所示,其中:
所示,其中:
①某电中性微粒一般不和其他元素的原子反应,这种微粒符号是
②某微粒的盐溶液,加入AgNO3溶液时会出现白色浑浊,这种微粒的电子式是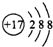
 .
.
③某微粒氧化性甚弱,但得到电子后还原性强且这种原子最外层有一个电子,这种微粒符号是
④某微粒具有还原性,且这种微粒失去2个电子即变为原子,这种微粒的符号是
(2)11-18号元素中,其单质相互化合能形成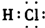
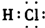 .
.
 所示,其中:
所示,其中:①某电中性微粒一般不和其他元素的原子反应,这种微粒符号是
Ar
Ar
.②某微粒的盐溶液,加入AgNO3溶液时会出现白色浑浊,这种微粒的电子式是


③某微粒氧化性甚弱,但得到电子后还原性强且这种原子最外层有一个电子,这种微粒符号是
K+
K+
.④某微粒具有还原性,且这种微粒失去2个电子即变为原子,这种微粒的符号是
S2-
S2-
(2)11-18号元素中,其单质相互化合能形成
4
4
种离子化合物,最高价氧化物对应水化物酸性最强的元素是Cl
Cl
;最高价氧化物对应水化物碱性最强的物质的化学式为NaOH
NaOH
;气态氢化物稳定性最强的物质的电子式是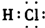
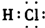
分析:(1)因为粒子种类与粒子结构间的关系是:阳离子的核内质子数>核外电子数;阴离子的核内质子数<核外电子数;原子的核内质子数=核外电子数.
①某电中性微粒一般不和其他元素的原子反应,是Ar;
②某微粒的盐溶液,加入AgNO3溶液时会出现白色浑浊,这种微粒是Cl-;
③某微粒氧化性甚弱,但得到电子后还原性强且这种原子最外层有一个电子,这种微粒K+;
④某微粒具有还原性,且这种微粒失去2个电子即变为原子,这种微粒的符号是S2-;
(2)11-18号元素中,其单质相互化合能形成离子化合物有NaCl、MgCl2、Na2S、MgS;最高价氧化物对应水化物酸性最强的元素是Cl;最高价氧化物对应水化物碱性最强的物质是NaOH;气态氢化物稳定性最强的物质是HCl.
①某电中性微粒一般不和其他元素的原子反应,是Ar;
②某微粒的盐溶液,加入AgNO3溶液时会出现白色浑浊,这种微粒是Cl-;
③某微粒氧化性甚弱,但得到电子后还原性强且这种原子最外层有一个电子,这种微粒K+;
④某微粒具有还原性,且这种微粒失去2个电子即变为原子,这种微粒的符号是S2-;
(2)11-18号元素中,其单质相互化合能形成离子化合物有NaCl、MgCl2、Na2S、MgS;最高价氧化物对应水化物酸性最强的元素是Cl;最高价氧化物对应水化物碱性最强的物质是NaOH;气态氢化物稳定性最强的物质是HCl.
解答:解:(1)因为粒子种类与粒子结构间的关系是:阳离子的核内质子数>核外电子数;阴离子的核内质子数<核外电子数;原子的核内质子数=核外电子数.
①某电中性微粒一般不和其他元素的原子反应,是Ar;
②某微粒的盐溶液,加入AgNO3溶液时会出现白色浑浊,这种微粒是Cl-,其电子式为: ;
;
③某微粒氧化性甚弱,但得到电子后还原性强且这种原子最外层有一个电子,这种微粒K+;
④某微粒具有还原性,且这种微粒失去2个电子即变为原子,这种微粒的符号是S2-;
故答案为:Ar; ;K+;S2-;
;K+;S2-;
(2)11-18号元素中,其单质相互化合能形成离子化合物有NaCl、MgCl2、Na2S、MgS,共4种;最高价氧化物对应水化物酸性最强的元素是Cl;最高价氧化物对应水化物碱性最强的物质是NaOH;气态氢化物稳定性最强的物质是HCl,其电子式为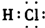 ,
,
故答案为:4;Cl;NaOH;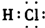 .
.
①某电中性微粒一般不和其他元素的原子反应,是Ar;
②某微粒的盐溶液,加入AgNO3溶液时会出现白色浑浊,这种微粒是Cl-,其电子式为:
 ;
;③某微粒氧化性甚弱,但得到电子后还原性强且这种原子最外层有一个电子,这种微粒K+;
④某微粒具有还原性,且这种微粒失去2个电子即变为原子,这种微粒的符号是S2-;
故答案为:Ar;
 ;K+;S2-;
;K+;S2-;(2)11-18号元素中,其单质相互化合能形成离子化合物有NaCl、MgCl2、Na2S、MgS,共4种;最高价氧化物对应水化物酸性最强的元素是Cl;最高价氧化物对应水化物碱性最强的物质是NaOH;气态氢化物稳定性最强的物质是HCl,其电子式为
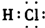 ,
,故答案为:4;Cl;NaOH;
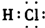 .
.点评:本题考查了元素的推断,电子式的书写,元素周期律,难度不大,注意有关知识的归纳记忆.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
(15分)下表为元素周期表的一部分,请参照元素A-K在表中的位置,
| 族 周期 | IA | | 0 | |||||
| 1 | A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | B | C | D | | |
| 3 | E | | F | G | | | K | |
(1)D、E、F的原子半径由大到小的顺序为_________________________。(用元素符号表示)
(2)B、C、D的第一电离能由大到小的顺序为_________________________。(用元素符号表示)
(3 E、F的最高价氧化物的水化物相互反应的离子方程式_____________________
(4)在B所形成的化合物HCHO、CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有____________;(写结构式,两种)
(5)由A、B、C、D、E元素中某几种组成的10电子微粒子中,含配位键的分子或离子有_________、_________;(写化学式)
(6)由F和K两种元素组成的化合物中,其化学键类型为______________。(填“共价键”或“离子键”),该化合物的二聚体的分子式为Al2Cl6,其结构式为下列四种中的一种,你认为正确的结构是______________。

(15分)下表为元素周期表的一部分,请参照元素A-K在表中的位置,
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
A |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
B |
C |
D |
|
|
|
3 |
E |
|
F |
G |
|
|
K |
|
请回答下列问题:
(1)D、E、F的原子半径由大到小的顺序为_________________________。(用元素符号表示)
(2)B、C、D的第一电离能由大到小的顺序为_________________________。(用元素符号表示)
(3 E、F的最高价氧化物的水化物相互反应的离子方程式_____________________
(4)在B所形成的化合物HCHO、CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有____________;(写结构式,两种)
(5)由A、B、C、D、E元素中某几种组成的10电子微粒子中,含配位键的分子或离子有_________、_________;(写化学式)
(6)由F和K两种元素组成的化合物中,其化学键类型为______________。(填“共价键”或“离子键”),该化合物的二聚体的分子式为Al2Cl6,其结构式为下列四种中的一种,你认为正确的结构是______________。