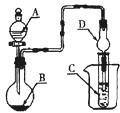
��Ŀ����
A��B��C��D��Ϊ��ѧ��ѧ�г��������ʣ�����֮���ת����ϵ����ͼ�����ֲ�������ȥ����
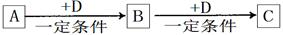
�Իش�
��1����D�Ǿ��������Եĵ��ʣ������ڶ����ڵ��������Ԫ��AΪ ����Ԫ�ط��ţ���
��2����D�ǽ������ʣ�D�ڳ�ʪ�Ŀ���������������ʴ��C��Һ�ڱ���ʱӦ�����������D��ֹ����ʣ�������D��C��Һ�ڿ����б��ʵ����ӷ���ʽΪ ����D���Ȼ����ˮ��Һ���ɲ����ղ����� ��
��3����A��B��C��Ϊ��������Ҿ����ؿ��к�����ߵĽ���Ԫ��E������Һ��A��C��Ӧ����B����д��Bת��ΪC�����п��ܵ����ӷ���ʽ ��
��4�����ڣ�1�����Ƴ���A������ڣ�3����E���ʵĻ����11.9gͶ��һ������ˮ�г�ַ�Ӧ��A��E��û��ʣ�࣬���ռ�����״���µ�����vL����������Һ����μ���Ũ��Ϊ2mol?L-1��H2SO4��Һ����100mLʱ��ɫ�����ﵽ���������v= ��
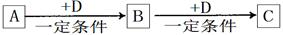
�Իش�
��1����D�Ǿ��������Եĵ��ʣ������ڶ����ڵ��������Ԫ��AΪ ����Ԫ�ط��ţ���
��2����D�ǽ������ʣ�D�ڳ�ʪ�Ŀ���������������ʴ��C��Һ�ڱ���ʱӦ�����������D��ֹ����ʣ�������D��C��Һ�ڿ����б��ʵ����ӷ���ʽΪ ����D���Ȼ����ˮ��Һ���ɲ����ղ����� ��
��3����A��B��C��Ϊ��������Ҿ����ؿ��к�����ߵĽ���Ԫ��E������Һ��A��C��Ӧ����B����д��Bת��ΪC�����п��ܵ����ӷ���ʽ ��
��4�����ڣ�1�����Ƴ���A������ڣ�3����E���ʵĻ����11.9gͶ��һ������ˮ�г�ַ�Ӧ��A��E��û��ʣ�࣬���ռ�����״���µ�����vL����������Һ����μ���Ũ��Ϊ2mol?L-1��H2SO4��Һ����100mLʱ��ɫ�����ﵽ���������v= ��
��1��Na
��2��4Fe2����O2+4H+��4Fe3��+2H2O�� Fe2 O3
��3��Al(OH)3��3H����Al3����3H2O��Al(OH)3��OH����AlO2����2H2O
��4��7.84L
��2��4Fe2����O2+4H+��4Fe3��+2H2O�� Fe2 O3
��3��Al(OH)3��3H����Al3����3H2O��Al(OH)3��OH����AlO2����2H2O
��4��7.84L
�����������1�������������Եĵ���ΪO2��Cl2��AΪ�����ڽ���Ԫ�أ�����ת����ϵ����A��Na��B��Na2O��C��Na2O2��D��O2��
��2��D���ڳ�ʪ�Ŀ���������������ʴ�Ľ������ʣ�����Ԫ�أ���C�к���Fe2+����FeCl3��ˮ��Һ���ɲ����գ�����Fe3+��ˮ���HCl�Ļӷ������յõ��IJ�����Fe2O3��
��3���ؿ��к�����ߵĽ���Ԫ����������A��B��C�ת����ϵ��֪B��Al(OH)3��A��C�зֱ���Al3+��AlO2��������ȷ�Ͼ��庬���ĸ����ӣ���Bת��ΪC��������Al(OH)3ת��ΪAl3������Al(OH)3ת��ΪAlO2����
��4������100 mL 2mol?L-1��H2SO4��Һʱ���������������ʱ��Һ�н���Na2SO4����ԭ���غ��֪��n(Na)=2n(Na2SO4)=2n(H2SO4)="2" ��0.1 L��2mol?L-1="0.4" mol����ԭ����������Ƶ�����Ϊ0.4 mol��23 mol·L��1=9.2g����������Ϊ11.9g��9.2g=2.7g���ʷ�Ӧ����H2�����Ϊ(
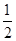 ��0.4mol+
��0.4mol+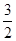 ��
��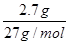 )��22.4L/mol="7.84" L��
)��22.4L/mol="7.84" L��
��ϰ��ϵ�д�
 �Ͻ�ƽ���Ȿϵ�д�
�Ͻ�ƽ���Ȿϵ�д� ����ѧ��Ӧ�����ϵ�д�
����ѧ��Ӧ�����ϵ�д�
�����Ŀ