题目内容
【题目】室温下,将氨气溶于水制得0.1mol/L的氨水溶液,据此回答:
(1)氨气溶于水的电离方程式_____________________;
(2)向0.1mol/L的氨水溶液中加入NH4Cl固体,电离平衡向___移动(填“左”或“右”),c(NH4+) ________(填“增大”“减小”或“不变”);
(3)向0.1mol/L的氨水溶液中加水稀释,下列选项的值增大的是____
A.c(NH4+) B.n(OH-) C.  D.
D. 
(4)已知室温时氨水的电离常数为1.77×10-5,0.1mol/L氨水中c(OH-)=_____________。
【答案】 NH3·H2O![]() NH4++OH- 左 增大 B、C
NH4++OH- 左 增大 B、C ![]() ×10-3
×10-3
【解析】(1)氨气与水反应生成一水合氨,一水合氨为弱碱,可部分电离出OH-和NH4+,电离方程式为NH3·H2O![]() NH4++OH-。
NH4++OH-。
(2)NH4Cl溶于水完全电离产生NH4+,使NH3·H2O![]() NH4++OH-平衡左移;根据化学平衡移动原理,改变影响平衡的一个条件,平衡向着减弱这种改变的方向移动,并不能抵消这种改变,所以c(NH4+)增大。
NH4++OH-平衡左移;根据化学平衡移动原理,改变影响平衡的一个条件,平衡向着减弱这种改变的方向移动,并不能抵消这种改变,所以c(NH4+)增大。
(3)A项,加水稀释促进NH3·H2O![]() NH4++OH-平衡右移,NH4+和OH-数目增多,但根据化学平衡移动原理,c(NH4+)减小,A错误;B项,由上面分析n(OH-)增大,B正确;C项,
NH4++OH-平衡右移,NH4+和OH-数目增多,但根据化学平衡移动原理,c(NH4+)减小,A错误;B项,由上面分析n(OH-)增大,B正确;C项, 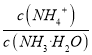 =
=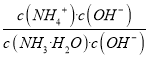 =
=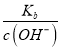 ,因为一定温度下Kb是常数,稀释c(OH-)减小,所以
,因为一定温度下Kb是常数,稀释c(OH-)减小,所以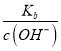 增大,故C正确;D项,
增大,故C正确;D项, 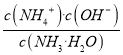 =Kb,一定温度下Kb是常数,故D错误。
=Kb,一定温度下Kb是常数,故D错误。
(4)0.1mol/L氨水中,NH3·H2O微弱电离,平衡时c(NH3·H2O)≈0.1mol/L,c(OH-)=c(NH4+),因为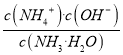 =Kb,代入数据得:
=Kb,代入数据得: ![]() =
=![]() ,解得c(OH-)=
,解得c(OH-)=![]() ×10-3mol/L。
×10-3mol/L。

【题目】一定温度下,在4个容积均为1 L的恒容容器中分别进行反应(各容器中A都足量)A(s)+B(g)![]() C(g)+D(g) ΔH =+100 kJ·mol-1,某时刻测得部分数据如下表:
C(g)+D(g) ΔH =+100 kJ·mol-1,某时刻测得部分数据如下表:
容器编号 | n(B)/mol | n(C)/mol | n(D)/mol | 反应时间/min | 反应速率 |
Ⅰ | 0.06 | 0.60 | 0.10 | t1 | v(正)=v(逆) |
Ⅱ | 0.12 | 1.20 | 0.20 | t2 | |
Ⅲ | 0.32 | 1.0 | 0 | 0 | |
Ⅳ | 0.12 | 0.30 | v(正)=v(逆) |
下列说法正确的是
A.容器Ⅰ中平均反应速率v(B)=0.04/t1 mol·L-1·min-1
B.t2时容器Ⅱ中v(正)>v(逆)
C.容器Ⅲ
D.容器Ⅳ中c(D)= 0.4 mol·L-1