题目内容
【题目】下图微粒的结构示意图,正确的是( )
A. Mg2+ ![]() B. Cl
B. Cl ![]()
C. Ar ![]() D. K
D. K ![]()
【答案】A
【解析】A.从结构示意图可以看出其核内质子数为12,核外电子数是10,则电子数小于质子数,所以该微粒带正电荷,表示的是镁离子,故A正确;B.其核内质子数为17,核外电子数是18,为氯离子,故B错误;C.氩原子核电荷数18,原子核外三个电子层,最外层8个电子,原子结构示意图为: 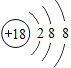 ,故C错误;D.核外电子排布规律:K层不超过2个电子;第二层不超过8个电子;最外层不超过8个电子,第三层是最外层含有9个电子,不符合排布规律,钾原子核电荷数19,原子核外四个电子层,最外层1个电子,原子结构示意图为:
,故C错误;D.核外电子排布规律:K层不超过2个电子;第二层不超过8个电子;最外层不超过8个电子,第三层是最外层含有9个电子,不符合排布规律,钾原子核电荷数19,原子核外四个电子层,最外层1个电子,原子结构示意图为: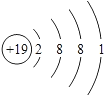 ,故D错误;故选A。
,故D错误;故选A。

【题目】某小组同学欲通过实验验证氯元素的非金属性强于硫元素。请帮他们完成实验报告。
(1)他们将过量硫粉与少量铁粉混合后隔绝空气加热,制得并分离出固体产物A。
实验步骤和操作 | 实验现象 | 实验结论或解释 |
①取少量A于试管中,加入足量稀硫酸 | 固体完全溶解,产生有臭鸡蛋气味的气体B | 硫粉与铁粉混合后隔绝空气加热,制得固体产物A是______(填化学式) |
②将B通入足量水中 | 得到无色溶液C | |
③向①的试管中加入KSCN溶液 | 溶液无明显变化 | |
④将浓盐酸滴到KMnO4固体上 | 产生黄绿色气体 | 反应生成氯气 |
⑤将红热的铁丝(少量)伸入上述黄绿色气体中 | 铁丝剧烈燃烧,产生大量棕黄色的烟 | 反应的化学方程式为 _________________ |
⑥将⑤中所得固体产物溶于水,在所得溶液中滴加KSCN溶液 | 观察到______________(填现象) |
(2)综合上述实验现象和结论,______(填“能”或“不能”)验证氯元素的非金属性强于硫元素,理由是__________________________________________________。
(3)某同学将上述实验中④所得氯气直接通入无色溶液C中,观察到产生淡黄色固体,反应的化学方程式为_______________________________,此实验______(填“能”或“不能”)验证氯元素的非金属性强于硫元素。
(4)某同学认为将步骤①中的稀硫酸换成稀盐酸,若同样产生有臭鸡蛋气味的气体B,则可以说明氯元素的非金属性强于硫元素,他的观点________(填“正确”或“错误”),原因是_________________________________________________________。
【题目】下表是元素周期表的一部分,回答下列有关问题:
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)写出下列元素符号:④_______;________。
(2)画出原子的结构示意图:⑤_________;________。
(3)在①~元素中,金属性最强的元素是_________,非金属性最强的元素是_______,最不活泼的元素是________ (均填元素符号)。
(4)元素⑦与元素⑧相比,非金属性较强的是_______(用元素符号表示),下列表述中能证明这一事实的是___________(填序号)。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)元素⑥是构成地壳的主要元素之一,其氧化物是现代光学及光纤制品的基本原料,该氧化物的化学式为_____。且该氧化物可溶解在强碱NaOH中其离子方程式_______。
