题目内容
(11分)下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
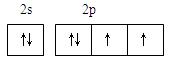
(1)请写出h元素的价电子排布图 ;
(2)ya3分子的电子式是 ,其分子的空间构型是 ,分子中y原子的杂化轨道类型是 , g2+可以与ya3以 键形成 [g (ya3)4]2+离子;
(3)请写出上述元素d3+的核外电子排布式 ,实验室常用形成一种红色配离子的方法检验该离子,该反应的离子方程式为
。
(4)请比较b、e、j三种元素的第一电离能由大到小的顺序 (写元素符号),其原因是
| a | | | |||||||||||||||
| | | | | f | y | h | i | | |||||||||
| | b | | e | | | | j | | |||||||||
| c | | | | | | | d | [ | d | | g | | l | | | | |
| | | | [ | | | | | | | | | | | | | | |
(2)ya3分子的电子式是 ,其分子的空间构型是 ,分子中y原子的杂化轨道类型是 , g2+可以与ya3以 键形成 [g (ya3)4]2+离子;
(3)请写出上述元素d3+的核外电子排布式 ,实验室常用形成一种红色配离子的方法检验该离子,该反应的离子方程式为
。
(4)请比较b、e、j三种元素的第一电离能由大到小的顺序 (写元素符号),其原因是
(11分)(1)(1分)
(2)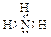 ;三角锥形;sp3杂化;配位(每空1分)
;三角锥形;sp3杂化;配位(每空1分)
(3)ls22s22p63s23p63d5(1分);Fe3+ + 3SCN- = Fe(SCN)3(2分,合理均给分)
(4)Cl>Mg>Al(1分);同一周期,随着原子序数的增加,元素的第一电离能呈现增大的趋势。但镁元素的最外层电子达到全充满的稳定结构,其第一电离能大于铝元素。(2分)

(2)
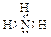 ;三角锥形;sp3杂化;配位(每空1分)
;三角锥形;sp3杂化;配位(每空1分)(3)ls22s22p63s23p63d5(1分);Fe3+ + 3SCN- = Fe(SCN)3(2分,合理均给分)
(4)Cl>Mg>Al(1分);同一周期,随着原子序数的增加,元素的第一电离能呈现增大的趋势。但镁元素的最外层电子达到全充满的稳定结构,其第一电离能大于铝元素。(2分)
略

练习册系列答案
相关题目
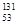 I和
I和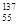 Cs的核内中子数分别为53和55
Cs的核内中子数分别为53和55 ,分子中C原子的杂化轨道方式是_____________;按原子轨道重叠方式判断COCl分子中的化学键类型为___________________。
,分子中C原子的杂化轨道方式是_____________;按原子轨道重叠方式判断COCl分子中的化学键类型为___________________。
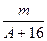 (A-n+8)mol
(A-n+8)mol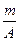 (A-n+6)mol
(A-n+6)mol