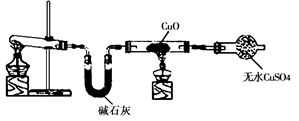
题目内容
市售氯化钾中所含杂质以Na+、Mg2+为主,也含有少量SO42—、Fe3+等。提纯过程如下:
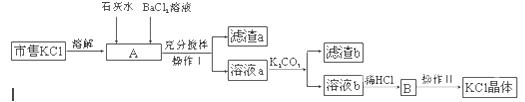
(1)操作I所用的玻璃仪器有 ;操作II的主要步骤是 。
(2)滤渣a的主要成分是 ;滤渣b的主要成分是 。
(3)检验BaCl2溶液是否加入过量,其详细操作过程为 。
(4)产品KCl晶体可能仍含少量的NaCl,进一步提纯的方法是 。

(1)操作I所用的玻璃仪器有 ;操作II的主要步骤是 。
(2)滤渣a的主要成分是 ;滤渣b的主要成分是 。
(3)检验BaCl2溶液是否加入过量,其详细操作过程为 。
(4)产品KCl晶体可能仍含少量的NaCl,进一步提纯的方法是 。
(16分)
(1)漏斗、烧杯、玻璃棒(3分) 蒸发浓缩、冷却结晶、过滤洗涤烘干(3分)
(2)Mg(OH)2、Fe(OH)3、BaSO4(3分) CaCO3、BaCO3(2分)
(3)向上层清液中滴加几滴BaCl2溶液,若有沉淀生成,则未过量,若无沉淀生成,则已过量(3分)
(4)重结晶(2分)
(1)漏斗、烧杯、玻璃棒(3分) 蒸发浓缩、冷却结晶、过滤洗涤烘干(3分)
(2)Mg(OH)2、Fe(OH)3、BaSO4(3分) CaCO3、BaCO3(2分)
(3)向上层清液中滴加几滴BaCl2溶液,若有沉淀生成,则未过量,若无沉淀生成,则已过量(3分)
(4)重结晶(2分)
试题分析:(1)根据操作I的目的是从混合物中分离滤渣和溶液,说明I是过滤,需要使用烧杯、漏斗、玻璃棒;II的目的是从B溶液中制取KCl晶体,说明II是结晶,主要步骤为蒸发浓缩、冷却结晶、过滤、洗涤、烘干;(2)加入过量石灰水,其中的氢氧根与铁离子、镁离子分别结合成氢氧化铁沉淀、氢氧化镁沉淀,加入过量氯化钡溶液,其中的钡离子与硫酸根离子结合生成硫酸钡沉淀,但它们引入钙离子、氢氧根、钡离子等新杂质,则滤渣a的主要成分Fe(OH)3、Mg(OH)2、BaSO4;溶液a中加入过量的K2CO3时,其中的碳酸根离子与钙离子、钡离子分别结合生成碳酸钙沉淀、碳酸钡沉淀,但是引入的碳酸根离子是新杂质,则滤渣b的主要成分是CaCO3、BaCO3;(3)将悬浊液A静置之后,向上层清液中滴加几滴BaCl2溶液,若有白色沉淀生成,则BaCl2未过量,若无白色沉淀生成,则BaCl2已过量;(4)对于已经使用结晶法制取的氯化钾晶体,除去其中所含少量NaCl的方法是重结晶。

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目

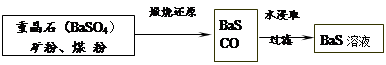
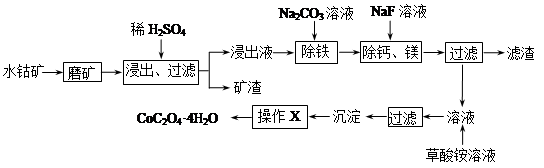
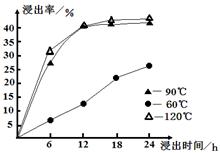
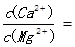 。
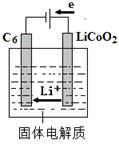
。 CoO2+LiC6,写出该电池放电时的正极反应式 。
CoO2+LiC6,写出该电池放电时的正极反应式 。